Диплом на тему Организация учебных экскурсий как средство формирования экологического мировоззрения и профориентации
Работа добавлена на сайт bukvasha.net: 2015-06-24Поможем написать учебную работу
Если у вас возникли сложности с курсовой, контрольной, дипломной, рефератом, отчетом по практике, научно-исследовательской и любой другой работой - мы готовы помочь.

Предоплата всего
от 25%

Подписываем
договор
Выпускная квалификационная работа
"Организация учебных экскурсий как средство формирования экологического мировоззрения и профориентации учащихся"
Введение
Глава 1. Учебно-воспитательное значение экскурсий
1.1 Методика учебных экскурсий по экологии
1.2 Выбор объекта экскурсии
Глава 2. Организационные вопросы подготовки экскурсии
2.1 Комплексные экскурсии
2.2 Проведение экскурсии
2.3 Подведение итогов экскурсии
Глава 3. Методические разработки
3.1 Мои уроки
Урок № 1. Экскурсия на водоочистную станцию
Урок № 2. Экскурсия в пожарное депо
Подготовительный урок
Урок № 3. Экскурсия в отопительную котельную
3.2 Лабораторные работы
Лабораторная работа № 1. "Моделирование этапов очистки воды"
3.3 Тестовые задания
Обсуждение результатов. Выводы
Литература
Основная цель данной работы - исследование возможности использования экскурсий для формирования экологического мировоззрения и профориентации школьников.
В связи с этим в работе решались следующие конкретные задачи:
1) анализ форм и методов организации и проведения экскурсий при изучении химии в средней школе;
2) определить роль и место экскурсий в процессе обучения и воспитания;
3) разработка уроков - экскурсий с экологическим содержанием в рамках данной темы;
4) апробация разработанных методик в МОУ СОШ гимназия № 5.
4) оценка уровня сформированности знаний при изучении тем по разработанным методическим подходам.
Предмет исследования - выбор соответствующих форм организации занятий, обеспечивающих формирование экологического мировоззрения в процессе использования экскурсий.
Объект исследования - познавательная деятельность учеников 8 классов в МОУ СОШ гимназии № 5.
Гипотеза: Систематическое использование экскурсий на уроках химии способствует развитию мыслительной деятельности, познавательного интереса учащихся, более прочному и глубокому усвоению материала и формированию экологического мировоззрения и профориентации учащихся.
Экскурсии имеют не только познавательное значение, но еще и большое воспитательное значение.
На экскурсиях учащиеся знакомятся как с технологией производства, так и непосредственно с трудом людей на производстве. Показывая примеры овладения передовой техникой и технологией, добросовестную работу людей, мы вызываем чувство гордости за нашу науку и технику, уважение к труду и к людям труда; дает возможность конкретно увидеть, тем самым способствует воспитанию у учащихся трудовой установки, осознанию необходимости добросовестного труда для общего блага.
Важна роль экскурсии и в экономическом воспитании учащихся. Учебные экскурсии на объекты промышленного производства дают возможность на конкретных примерах раскрыть экономическую эффективность комплексной переработки сырья, рациональное использование производственных отходов, показать перспективные направления дальнейшего совершенствования технологий производства, обеспечение его технологической гибкости.
Не менее важно и то, что в процессе экскурсий учащиеся не только наблюдают, каково содержание труда работников массовых химических профессий. Они узнают о том, какие условия создаются на производстве, чтобы не только облегчить труд людей путем механизации и автоматизации производственных процессов, но и сделать его более содержательным, как на предприятии заботятся об охране здоровья работников, о повышении их культурно - технического уровня и т.д. Все это в определенной мере способствует проявлению у учащихся склонностей к той или иной профессии, более сознательному выбору будущей специальности; уменьшает затруднения, возникающие у выпускников средней школы в тот период, когда они начинают трудиться в сфере материального производства.
Учебные экскурсии повышают квалификацию учителя. Они позволяют ему полнее увязывать учебный материал с жизнью, более конкретно и эмоционально излагать его, что в свою очередь способствует более глубокому и прочному усвоению знаний учащимися. Непосредственное наблюдение во время экскурсий производственных процессов дает возможность организовать изготовление силами учащихся наглядных пособий по химии: коллекций, схем, макетов, моделей, помогает развивать графическую грамотность школьников, умение чертить схемы аппаратов, эскизы моделей и др. [1].
Подготовка учителя к проведению учебных экскурсий начинается с выбора объекта экскурсии еще при составлении годового календарного плана. В этом учителю может помочь следующий перечень (см. таблицу).
С учетом программных требований и производственного окружения школы учитель еще до начала учебного года намечает объекты учебных экскурсий. При этом он стремится к тому, чтобы каждый учащийся в период изучения химии посетил как промышленные предприятия различного профиля, так и сельскохозяйственные и другие объекты, для работы, на которых необходимо знание предмета экологии и химии.
Таблица 1.
Возможные объекты учебных экскурсий
Понятно, что проведение всех этих экскурсий невозможно, так как предприятия, включенные в перечень, не могут быть расположены вблизи школы. Учитель может провести учебные экскурсии лишь на те объекты, которые будут практически доступны.
Отсутствие вблизи школы химических производств, что типично для сельских школ, не означает, что проведение экскурсий по химии не возможно.
Учебные экскурсии можно проводить и на нехимические объекты при условии, что на них осуществляются операции, связанные с химическими процессами. Такими объектами могут аптеки, пожарные депо, предприятия пищевой промышленности, текстильные фабрики и другие предприятия местной промышленности. Если на этих экскурсиях и нельзя изучать важнейшие химические производства, то учащиеся все же приобретут конкретные представления о практическом применении различных химических процессов, изучаемых в школьном курсе химии.
Вместе с тем следует помнить, что многие химические производства, на которых осуществляются сложные химические реакции, недоступные пониманию учащихся средней школы, являются неподходящими объектами для учебных экскурсий.
Выбирая предприятия для школьных учебных экскурсий, учитель должен руководствоваться следующими критериями: соответствия содержания экскурсии программе; доступность экскурсии для понимания учащимися; значимость данного промышленного объекта для народного хозяйства; уровень технологии и технической оснащенности, его соответствие современными требованиям; безопасность производства. Все это свидетельствует о том, что выбор объекта для учебной экскурсии по химии всякий раз должен происходить с учетом политехнической значимости объекта и познавательных возможностей учащихся [1-3, 13-17, 22,25].
Итак, наметив объекты, составив план на данный учебный год и определив ориентировочно время проведения каждой из них, учитель должен сам тщательно изучить те производства, которые он включил в план. Для этого он рассматривает теоретический материал по теме экскурсии, используя специальную литературу. Кроме того, необходимо, чтобы учитель, прежде всего сам, предварительно побывал на предприятии, на которое планируется экскурсия. Существенную помощь учителям в этой работе оказывают кабинеты химии областных (городских) институтов усовершенствования учителей и методические кабинеты отделов народного образования, которые систематически в период курсовой подготовки организует для учителей химии производственные экскурсии.
Далее учитель намечает цель экскурсии и определяет объем знаний, которые должны получить учащиеся во время экскурсии. При этом следует учитывать содержание соответствующего учебного вопроса по действующей программе.
Маршрут экскурсии составляется таким образом, чтобы продолжительность экскурсии не превышала двух часов, не считая времени, потраченного на переход или проезд от школы до завода. Экскурсии, затянувшиеся по времени, слишком утомляют учащихся. Необходимо также предусмотреть безопасность маршрута и возможность перерыва для отдыха учащихся (через час после начала экскурсии).
При подготовке учебной экскурсии на производство особое внимание надо уделять безопасности учащихся. Проведение любой производственной экскурсии должно проходить только после того, как школьники ознакомятся с правилами техники безопасности, строго соблюдать которые во время экскурсии обязан каждый из них.
При предварительном посещении предприятия учитель должен заранее обсудить с экскурсоводом маршрут экскурсии, объем и характер разъяснений, необходимых по ходу экскурсии; выявить источники возможной опасности (железнодорожные переезды, подъемные краны, газоопасные места и др.), взять их под особый контроль. Чаще всего экскурсии проводят сотрудники предприятий. Привлечение инженерно-технических работников к проведению учебных экскурсии со школьниками желательно ввиду их высокой осведомленности в производственных вопросах. Однако следует помнить, что специалисты предприятия могут увлекаться техническими деталями, а это вызывает перегрузку учащихся второстепенным материалом. Чтобы это не случилось, необходимо всякий раз ставить в известность экскурсовода о том, каков уровень подготовки учащихся и какие знания они должны приобрести во время экскурсии.
Практика показывает, что лучшими экскурсоводами являются сотрудники химических лабораторий предприятий. Они быстрее вводят учащихся в существо дела, не прибегают в своих объяснениях к подробностям узкотехнического направления, а придерживаются широко изученного плана, более умело знакомят учащихся с проблемами прикладной химии (экологии) данной отрасли, с тем научно - техническими задачами, которые призваны решать химическая (экологическая) лаборатория и все предприятие в целом, выпуская соответствующую химическую продукцию.
Руководящая роль на экскурсии должна принадлежать учителю. Если учитель заметил, что экскурсовод увлекся и излагает материал, не учитывая уровень подготовленности школьников, можно обратиться к нему с опросами, которые напомнят экскурсоводу о теме, что не позволит превратить экскурсию в лекцию на предприятии. Учитель должен обратить внимание экскурсовода на то, чтобы во время объяснения устройства аппаратов он не поворачивался спиной к учащимся, как это часто бывает у недостаточно опытных экскурсоводов. Следует помнить, что в производственных экскурсиях всегда остро встает проблема слышимости. Пользование громкоговорителем чаще всего не целесообразно: это лишь усиливает шум в цехе. Еще бесполезнее пытаться перекричать шум действующего оборудования. Самое лучшее в таких случаях - изложить материал перед входом шумный цех или участок, а на месте давать лишь краткие, самые необходимые пояснения. Отвечать на вопросы следует уже при выходе из цеха.
Если учитель хорошо знает данное производство, то лучше ему самому поводить экскурсию, используя помощь инженерно - технических работников, сопровождающих экскурсию.
Экскурсия как особая форма организации учебного процесса требует специальной и довольно основательной предварительной подготовке учащихся. От этого зависит весь ее результат. Опытный учитель на протяжении целого ряда уроков фиксирует внимание учащихся на материале, который в той или иной мере связан с предстоящей экскурсией. Накануне же самой экскурсии во время специального вводного занятия в классе учитель проводит следующую работу: а) объясняет учащимся цель экскурсии; б) знакомит в общих чертах с объектом; в) сообщает учащимся знания, необходимые для понимания экскурсионного материала; г) демонстрирует чертежи и рисунки, облегчающие наблюдение и изучение аппаратов и процессов; д) знакомит с планом экскурсии; е) сообщает учащимся время и место сбора, маршрут экскурсии, делит класс на группы, каждая из которых получает конкретное здание. Учитель указывает, на что именно, кроме общего осмотра всего объекта, следует обратить особое внимание, что зарисовать, записать, основываясь на документальном материале (история завода, люди, планы, место в отрасли), кому на производстве следует взять образцы сырья, полупродуктов, готовой продукции и для этой цели изготовить и взять с собой посуду с чистыми этикетками, полиэтиленовые мешочки и т.д. Учитель называет также темы сообщений по материалам экскурсии и рекомендует дополнительную литературу по теме экскурсии.
На вводном занятии учитель разъясняет правила техники безопасности, но это не означает, что учащиеся нужно загружать изучением всех правил. Они, прежде всего, должны усвоить их главное содержание. Учащиеся обязательно должны знать следующие правила поведения: на пятна жидкостей, различных на полу, не наступать; аппараты и сосуды не трогать; образцы без разрешения начальника цеха или мастера не брать.
Вся подготовительная работа должна строиться так, чтобы вызвать у учащихся интерес к экскурсии. Четкие указания о том, на что следует обратить внимание, предупреждают расплывчатость и бессодержательность наблюдений, обеспечивают избирательность и способствует установлению логических связей между самыми важными производственными явлениями. План экскурсии по этапам, указания о наблюдениях и вопросы, которые следует выяснить, учащиеся записывают в тетради, оставляя под каждым вопросом место для записей во время экскурсии.
"Организация учебных экскурсий как средство формирования экологического мировоззрения и профориентации учащихся"
Оглавление
ОглавлениеВведение
Глава 1. Учебно-воспитательное значение экскурсий
1.1 Методика учебных экскурсий по экологии
1.2 Выбор объекта экскурсии
Глава 2. Организационные вопросы подготовки экскурсии
2.1 Комплексные экскурсии
2.2 Проведение экскурсии
2.3 Подведение итогов экскурсии
Глава 3. Методические разработки
3.1 Мои уроки
Урок № 1. Экскурсия на водоочистную станцию
Урок № 2. Экскурсия в пожарное депо
Подготовительный урок
Урок № 3. Экскурсия в отопительную котельную
3.2 Лабораторные работы
Лабораторная работа № 1. "Моделирование этапов очистки воды"
3.3 Тестовые задания
Обсуждение результатов. Выводы
Литература
Введение
Учебные экскурсии являются важным средством образования, трудового воспитания и профориентации учащихся. Связь экскурсий с предшествующим и последующим изложением учебного материала, иллюстрируемого наглядными пособиями и химическими опытами, дает представление о практическом использовании химических веществ и химических процессов в производстве. Во время экскурсии на производство учащиеся знакомятся со свойствами веществ исходных материалов и полученных продуктов, устройством и работой основных аппаратов, с технологическим процессом в целом, что формирует у учащихся яркие образы и способствует более прочному усвоению научных основ производства. Экскурсии способствуют более конкретному восприятию тех производств, которые учащиеся не имели возможности наблюдать непосредственно. Поэтому актуальность изучаемой темы не вызывает сомнения.Основная цель данной работы - исследование возможности использования экскурсий для формирования экологического мировоззрения и профориентации школьников.
В связи с этим в работе решались следующие конкретные задачи:
1) анализ форм и методов организации и проведения экскурсий при изучении химии в средней школе;
2) определить роль и место экскурсий в процессе обучения и воспитания;
3) разработка уроков - экскурсий с экологическим содержанием в рамках данной темы;
4) апробация разработанных методик в МОУ СОШ гимназия № 5.
4) оценка уровня сформированности знаний при изучении тем по разработанным методическим подходам.
Предмет исследования - выбор соответствующих форм организации занятий, обеспечивающих формирование экологического мировоззрения в процессе использования экскурсий.
Объект исследования - познавательная деятельность учеников 8 классов в МОУ СОШ гимназии № 5.
Гипотеза: Систематическое использование экскурсий на уроках химии способствует развитию мыслительной деятельности, познавательного интереса учащихся, более прочному и глубокому усвоению материала и формированию экологического мировоззрения и профориентации учащихся.
Глава 1. Учебно-воспитательное значение экскурсий
Преподавание химии в школе нельзя ограничивать только сведениями из учебников и тем материалом, который учащиеся получают на уроках. Большую роль учителю могут оказать учебные экскурсии на различные предприятия и народнохозяйственные объекты.Экскурсии имеют не только познавательное значение, но еще и большое воспитательное значение.
На экскурсиях учащиеся знакомятся как с технологией производства, так и непосредственно с трудом людей на производстве. Показывая примеры овладения передовой техникой и технологией, добросовестную работу людей, мы вызываем чувство гордости за нашу науку и технику, уважение к труду и к людям труда; дает возможность конкретно увидеть, тем самым способствует воспитанию у учащихся трудовой установки, осознанию необходимости добросовестного труда для общего блага.
Важна роль экскурсии и в экономическом воспитании учащихся. Учебные экскурсии на объекты промышленного производства дают возможность на конкретных примерах раскрыть экономическую эффективность комплексной переработки сырья, рациональное использование производственных отходов, показать перспективные направления дальнейшего совершенствования технологий производства, обеспечение его технологической гибкости.
Не менее важно и то, что в процессе экскурсий учащиеся не только наблюдают, каково содержание труда работников массовых химических профессий. Они узнают о том, какие условия создаются на производстве, чтобы не только облегчить труд людей путем механизации и автоматизации производственных процессов, но и сделать его более содержательным, как на предприятии заботятся об охране здоровья работников, о повышении их культурно - технического уровня и т.д. Все это в определенной мере способствует проявлению у учащихся склонностей к той или иной профессии, более сознательному выбору будущей специальности; уменьшает затруднения, возникающие у выпускников средней школы в тот период, когда они начинают трудиться в сфере материального производства.
Учебные экскурсии повышают квалификацию учителя. Они позволяют ему полнее увязывать учебный материал с жизнью, более конкретно и эмоционально излагать его, что в свою очередь способствует более глубокому и прочному усвоению знаний учащимися. Непосредственное наблюдение во время экскурсий производственных процессов дает возможность организовать изготовление силами учащихся наглядных пособий по химии: коллекций, схем, макетов, моделей, помогает развивать графическую грамотность школьников, умение чертить схемы аппаратов, эскизы моделей и др. [1].
1.1 Методика учебных экскурсий по экологии
Учебные экскурсии на химические и др. объекты являются особой формой организации учебного процесса; их можно проводить и во внеурочное время, и в дни школьных каникул. Реальное планирование календарных сроков проведения экскурсий - дело очень сложное, зависящее от ряда обстоятельств, иногда связанное и с выездом школьников в областной центр и другие регионы и страны. Это не означает, что экскурсию следует рассматривать как дополнительное мероприятие, оторванное от урока. Наибольший учебно-воспитательный эффект дает экскурсия, проеденная как своеобразный урок в условиях производства. Именно поэтому в объяснительной записке к программе указанно, что учебные экскурсии следует проводить за счет времени, отводимого на изучение соответствующих тем курса. Опыт показывает, что учителя экологии (химии) обычно проводят 1-2 экскурсии в год. При этом объект, содержание и методы проведения экскурсии определяются не всегда достаточно рационально. Рекомендуется проводить не менее одной экскурсии за учебный год в 8-9 классах (продолжительность 2 часа) и не менее 2 в 10-11 классах.1.2 Выбор объекта экскурсии
Каждая из производственных экскурсий должна быть проведена с максимальным учебно-воспитательным эффектом, что требует тщательной подготовки, как учителя, так и учащихся.Подготовка учителя к проведению учебных экскурсий начинается с выбора объекта экскурсии еще при составлении годового календарного плана. В этом учителю может помочь следующий перечень (см. таблицу).
С учетом программных требований и производственного окружения школы учитель еще до начала учебного года намечает объекты учебных экскурсий. При этом он стремится к тому, чтобы каждый учащийся в период изучения химии посетил как промышленные предприятия различного профиля, так и сельскохозяйственные и другие объекты, для работы, на которых необходимо знание предмета экологии и химии.
Таблица 1.
Возможные объекты учебных экскурсий
| 8 класс | 9 класс | 10 класс | 11 класс |
| Минералогические и краеведческие музеи. Химические лаборатории промышленных и сельскохозяйственных предприятий. Водоочистительные сооружения. Карьеры добычи полезных ископаемых. Отопительные котельные. | Производство серной кислоты. Заводы по производству минеральных удобрений. Цементные, кирпичные и стекольные заводы. Предприятия по производству чугуна, стали и алюминия. Пожарное депо. | Предприятия по переработке нефти и природного газа. | Заводы по производству пластмасс, синтетических и искусственных волокон. Животноводческие фермы. |
Отсутствие вблизи школы химических производств, что типично для сельских школ, не означает, что проведение экскурсий по химии не возможно.
Учебные экскурсии можно проводить и на нехимические объекты при условии, что на них осуществляются операции, связанные с химическими процессами. Такими объектами могут аптеки, пожарные депо, предприятия пищевой промышленности, текстильные фабрики и другие предприятия местной промышленности. Если на этих экскурсиях и нельзя изучать важнейшие химические производства, то учащиеся все же приобретут конкретные представления о практическом применении различных химических процессов, изучаемых в школьном курсе химии.
Вместе с тем следует помнить, что многие химические производства, на которых осуществляются сложные химические реакции, недоступные пониманию учащихся средней школы, являются неподходящими объектами для учебных экскурсий.
Выбирая предприятия для школьных учебных экскурсий, учитель должен руководствоваться следующими критериями: соответствия содержания экскурсии программе; доступность экскурсии для понимания учащимися; значимость данного промышленного объекта для народного хозяйства; уровень технологии и технической оснащенности, его соответствие современными требованиям; безопасность производства. Все это свидетельствует о том, что выбор объекта для учебной экскурсии по химии всякий раз должен происходить с учетом политехнической значимости объекта и познавательных возможностей учащихся [1-3, 13-17, 22,25].
Глава 2. Организационные вопросы подготовки экскурсии
Изучение в классе химических производств должно происходить после того, как учащиеся овладеют химическими знаниями, необходимыми для понимания научных основ данного производства, и сопровождаться использованием различных средств наглядности. Учащиеся сначала должны ознакомиться с составом, свойствами, применением вещества, что позволит им оценить его народнохозяйственное значение, и лишь затем, т.е. в заключение изучаемой темы или раздела, следует рассматривать промышленный способ получения этого вещества.Итак, наметив объекты, составив план на данный учебный год и определив ориентировочно время проведения каждой из них, учитель должен сам тщательно изучить те производства, которые он включил в план. Для этого он рассматривает теоретический материал по теме экскурсии, используя специальную литературу. Кроме того, необходимо, чтобы учитель, прежде всего сам, предварительно побывал на предприятии, на которое планируется экскурсия. Существенную помощь учителям в этой работе оказывают кабинеты химии областных (городских) институтов усовершенствования учителей и методические кабинеты отделов народного образования, которые систематически в период курсовой подготовки организует для учителей химии производственные экскурсии.
Далее учитель намечает цель экскурсии и определяет объем знаний, которые должны получить учащиеся во время экскурсии. При этом следует учитывать содержание соответствующего учебного вопроса по действующей программе.
Маршрут экскурсии составляется таким образом, чтобы продолжительность экскурсии не превышала двух часов, не считая времени, потраченного на переход или проезд от школы до завода. Экскурсии, затянувшиеся по времени, слишком утомляют учащихся. Необходимо также предусмотреть безопасность маршрута и возможность перерыва для отдыха учащихся (через час после начала экскурсии).
При подготовке учебной экскурсии на производство особое внимание надо уделять безопасности учащихся. Проведение любой производственной экскурсии должно проходить только после того, как школьники ознакомятся с правилами техники безопасности, строго соблюдать которые во время экскурсии обязан каждый из них.
При предварительном посещении предприятия учитель должен заранее обсудить с экскурсоводом маршрут экскурсии, объем и характер разъяснений, необходимых по ходу экскурсии; выявить источники возможной опасности (железнодорожные переезды, подъемные краны, газоопасные места и др.), взять их под особый контроль. Чаще всего экскурсии проводят сотрудники предприятий. Привлечение инженерно-технических работников к проведению учебных экскурсии со школьниками желательно ввиду их высокой осведомленности в производственных вопросах. Однако следует помнить, что специалисты предприятия могут увлекаться техническими деталями, а это вызывает перегрузку учащихся второстепенным материалом. Чтобы это не случилось, необходимо всякий раз ставить в известность экскурсовода о том, каков уровень подготовки учащихся и какие знания они должны приобрести во время экскурсии.
Практика показывает, что лучшими экскурсоводами являются сотрудники химических лабораторий предприятий. Они быстрее вводят учащихся в существо дела, не прибегают в своих объяснениях к подробностям узкотехнического направления, а придерживаются широко изученного плана, более умело знакомят учащихся с проблемами прикладной химии (экологии) данной отрасли, с тем научно - техническими задачами, которые призваны решать химическая (экологическая) лаборатория и все предприятие в целом, выпуская соответствующую химическую продукцию.
Руководящая роль на экскурсии должна принадлежать учителю. Если учитель заметил, что экскурсовод увлекся и излагает материал, не учитывая уровень подготовленности школьников, можно обратиться к нему с опросами, которые напомнят экскурсоводу о теме, что не позволит превратить экскурсию в лекцию на предприятии. Учитель должен обратить внимание экскурсовода на то, чтобы во время объяснения устройства аппаратов он не поворачивался спиной к учащимся, как это часто бывает у недостаточно опытных экскурсоводов. Следует помнить, что в производственных экскурсиях всегда остро встает проблема слышимости. Пользование громкоговорителем чаще всего не целесообразно: это лишь усиливает шум в цехе. Еще бесполезнее пытаться перекричать шум действующего оборудования. Самое лучшее в таких случаях - изложить материал перед входом шумный цех или участок, а на месте давать лишь краткие, самые необходимые пояснения. Отвечать на вопросы следует уже при выходе из цеха.
Если учитель хорошо знает данное производство, то лучше ему самому поводить экскурсию, используя помощь инженерно - технических работников, сопровождающих экскурсию.
Экскурсия как особая форма организации учебного процесса требует специальной и довольно основательной предварительной подготовке учащихся. От этого зависит весь ее результат. Опытный учитель на протяжении целого ряда уроков фиксирует внимание учащихся на материале, который в той или иной мере связан с предстоящей экскурсией. Накануне же самой экскурсии во время специального вводного занятия в классе учитель проводит следующую работу: а) объясняет учащимся цель экскурсии; б) знакомит в общих чертах с объектом; в) сообщает учащимся знания, необходимые для понимания экскурсионного материала; г) демонстрирует чертежи и рисунки, облегчающие наблюдение и изучение аппаратов и процессов; д) знакомит с планом экскурсии; е) сообщает учащимся время и место сбора, маршрут экскурсии, делит класс на группы, каждая из которых получает конкретное здание. Учитель указывает, на что именно, кроме общего осмотра всего объекта, следует обратить особое внимание, что зарисовать, записать, основываясь на документальном материале (история завода, люди, планы, место в отрасли), кому на производстве следует взять образцы сырья, полупродуктов, готовой продукции и для этой цели изготовить и взять с собой посуду с чистыми этикетками, полиэтиленовые мешочки и т.д. Учитель называет также темы сообщений по материалам экскурсии и рекомендует дополнительную литературу по теме экскурсии.
На вводном занятии учитель разъясняет правила техники безопасности, но это не означает, что учащиеся нужно загружать изучением всех правил. Они, прежде всего, должны усвоить их главное содержание. Учащиеся обязательно должны знать следующие правила поведения: на пятна жидкостей, различных на полу, не наступать; аппараты и сосуды не трогать; образцы без разрешения начальника цеха или мастера не брать.
Вся подготовительная работа должна строиться так, чтобы вызвать у учащихся интерес к экскурсии. Четкие указания о том, на что следует обратить внимание, предупреждают расплывчатость и бессодержательность наблюдений, обеспечивают избирательность и способствует установлению логических связей между самыми важными производственными явлениями. План экскурсии по этапам, указания о наблюдениях и вопросы, которые следует выяснить, учащиеся записывают в тетради, оставляя под каждым вопросом место для записей во время экскурсии.
2.1 Комплексные экскурсии
Учебные экскурсии подразделяются на тематические и комплексные.На тематических экскурсиях учащиеся знакомятся с конкретными производствами, например с производством серной кислоты или синтетического аммиака, используя знания, получаемые на уроках экологии (химии). На комплексных экскурсиях учащиеся изучают природные или производственные объекты, используя знания различных учебных предметов (экологии, химии, физики, географии и др.).
Учебные производственные экскурсии по экологии целесообразнее поводить как комплексные. Такие экскурсии позволяют экономить время учащихся. Они проводятся совместно учителями 2-3 предметов на одно предприятие. Перед учителями раскрываются большие возможности для осуществления межпредметных связей экологии с химией, биологией, географией, историей и другими предметами. В результате учащиеся глубоко понимают устройство различных аппаратов, воздействие на окружающую среду, ход технологического процесса, таким образом, разностороннее представление о производстве, усваивают его научные основы с различных точек зрения, что способствует успешному формированию общих для различных наук понятий и на этой основе лучшему усвоению общих для различных наук понятий и на этой основе лучшему усвоению общих научных закономерностей. А это, как известно, имеет важное значение для формирования у учащихся единой научной картины мира, элементов диалектико-материалистического мировоззрения. Межпредметный подход к поведению экскурсий важен еще и потому, что хотя современное производство и подразделяет на ряд главных отраслей (энергетическое, механическое, химическое, сельскохозяйственное и др.), но на практике все отрасли производства теснейшим образом сазаны между собой, особенно когда речь заходит об охране окружающей среды и рациональном использовании природных ресурсов, экологической безопасности.
Так как между экологическими, физическими и химическими процессами наблюдается тесная связь, производственные экскурсии чаще всего проводятся как комплексные по экологии, химии и физике.
2.2 Проведение экскурсии
Тщательная подготовка учащихся в классе предстоящей экскурсии - необходимое, но еще недостаточное условие для ее успешного проведения. Чтобы цель экскурсии была в полной мере достигнута, и учащиеся при посещении предприятия приобрели новые знания и яркие впечатления, необходимо серьезно продумать методику проведения всех этапов экскурсии. Прежде всего, следует разработать ее план, который может быть следующим:Краткая характеристика данного производства в целом (история возникновения, ее развитие, задачи производства, наносимый ущерб окружающей среде, перспективы дальнейшего развития).
Продукт производства, его народнохозяйственное значение.
Сырье и его подготовка.
Химические реакции, лежащие основе переработки сырья в готовый продукт, условия их протекания и управление ими.
Важнейшие аппараты, в которых происходят технологические процессы каждой отдельной стадии, их устройство и принцип действия.
Наносимый ущерб выбросами предприятия в окружающую среду, то есть антропогенное воздействие.
Общие научные принципы химического производства, осуществляемые при получении данного продукта.
Безусловно, этот план является ориентировочным. Ознакомление с производством может быть или менее полным в зависимости от объекта экскурсии. Нет необходимости подробно знакомить учащихся со всеми участками производства, поскольку это вызовет перегрузку. Поэтому в предложенном плане допускаются коррективы в зависимости от объекта экскурсии; при этом следует учитывать программные требования, предъявляемые к изучению данного производства. В ряде случаев первый пункт плана можно перенести в конец.
Методика проведения экскурсии во многом зависит от того, можно ли на данном предприятии давать подробные разъяснения возле самих аппаратов или необходимо предварительно рассказать и лишь затем показать. В любом случае следует предложить экскурсоводу до начала экскурсии провести с учащимися краткую вводную беседу (15-20 мин.), которой он может рассказать об истории предприятия, о свойствах выпускаемого продукта, познакомить вкратце с общей технологической схемой производства, напомнить правила по технике безопасности на территории завода.
Вводную беседу, чтобы не отвлекать внимание учащихся, лучше проводить в помещении, например в музее предприятия или техническом кабинете. Местом проведения вводной беседы могут быть и клуб предприятия, учебная аудитория, если только они снабжены нужными иллюстрациями, схемами, макетами, моделями, и прочими наглядными пособиями.
Для проведения экскурсии класс делится на две группы, по 15-20 человек. Каждая группа посещает предприятие отдельно или одновременно. В этом случае одну группу ведет работник предприятия, а другую - учитель. В начале и в конце экскурсии об их самочувствии. Учащихся предупреждают, что во время экскурсии нельзя отходить от группы, задерживаться возле отдельных аппаратов, особенно в химических цехах, так как в аппаратах, работающих под давлением, возможна утечка продуктов, вредно действующих на организм человека. Соблюдение всех предупредительных мер позволит избежать несчастных случаев во время экскурсии.
При осмотре объекта учащимся следует расположиться полукругом в два ряда на некотором расстоянии от экскурсовода.
Учебная производственная экскурсия строится на сочетании рассказа с показом. После напоминания о технике безопасности начинается более подробное ознакомление по схеме с важнейшими технологическими узлами всех стадий производства от исходного сырья до готового продукта. При этом учащимся вначале показывают действующий объект целом, после чего экскурсовод переходит к разбору частных вопросов. Тем самым определяется его рассказа, касающегося сначала самого объекта, а затем его функции, назначения и т.д.
Переход при объяснении от одного вопроса к другому должен быть логичным, отражать переход от одной стадии производства к последующей в полном соответствии с технологическими процессами. После разбора некоторых вопросов в зависимости от их содержании и значения могут быть сделаны частые выводы. Так, находясь в машинном зале кислородного цеха, где установлено множество агрегатов и почти отсутствует обслуживающий персонал, или, показывая установку синтеза аммиака, оснащенную контрольно-измерительными приборами, показания которых передаются на общий щит управления и там регистрируются, следует обратить внимание учащихся на автоматизацию контроля и управления процессом синтеза. Благодаря этому удается устойчиво поддерживать заданный режим, повышать выход продукта и производительность аппаратов, увеличивать производительность труда. Надо напомнить школьникам о значении технического прогресса, о задачах дальнейшей автоматизации производства и уменьшения вредных выбросов в атмосферу.
Во время экскурсии внимание учащихся обращают на следующие особенности современного химического производства: а) непрерывность процессов, автоматизация работы каждого аппарата и согласованность действий всех аппаратов изучаемой установки; б) незначительное число людей, обслуживающих аппараты, и повышенная квалификация работников; в) роль общезаводских и цеховых лабораторий в осуществлении контроля выброса в атмосферу вредных веществ и физико-химического контроля над производством.
Учащихся при проведении учебной производственной экскурсии необходимо познакомить с основными профессиями данного производства. Школьники должны увидеть работу представителей ведущих профессий химических производств - экологов, лаборантов, инженеров.
Не следует забывать и о посещении химической лаборатории предприятия. Возможно, не вся работа лаборатории будет понятной учащимся; потому не надо стремиться объяснить все химические реакции, проводимые там, в процессе анализов. Но назначение лаборатории, основные виды работ должны быть разъяснены школьникам. Знакомство с работой лаборатории убеждает учащихся зависимости в значимости химических знаний для успехов производства, поэтому они будут более серьезно относиться к изучению предмета.
В завершение экскурсии проводится краткая заключительная беседа, во время которой экскурсовод отвечает на вопросы учащихся и учителя, знакомит их с перспективами развития производства, отмечает значение данной отрасли промышленности в народном хозяйстве и значение конкретного донного завода. При этом большой эффект дает метод сравнения.
В процессе заключительной беседы, если об этом не говорилось в вводной части, следует рассказать учащимся о смежных предприятиях, с которыми связан данный завод непосредственно (поставщики сырья, потребители продукции); отметить какие меры принимаются на заводе по охране окружающей среды, по рациональному использованию водных ресурсов и отходов производства.
После краткого обобщения содержания экскурсии учащиеся получают ответы на вопросы. Затем экскурсовод может и сам предложить несколько вопросов с тем, чтобы убедиться, поняли ли они самое главное из того, что наблюдали в процессе экскурсии, особенно то, что не является предметом изучения в школе. Дополнительные вопросы учащимся может поставить и учитель [4, 5-9, 11, 12].
2.3 Подведение итогов экскурсии
Заключительная беседа экскурсовода не завершает подведение итогов экскурсии. Знания, приобретенные учащимся на производственной экскурсии, требуют систематизации, развития, закрепления. Это достигается в процессе последующей классной и внеклассной работы с материалом экскурсии.К первому после экскурсии уроку экологии, пока еще свежи в памяти впечатления, учащиеся должны оформить свои записи, сделанные по ходу экскурсии, и подготовиться по ним отвечать.
На итоговом уроке проводится обобщающая беседа, первый этап который строится в основном по тому же плану, что и экскурсия. На подготовительном к экскурсии уроке учитель рассказал учащимся о том, что они увидят на производстве, на что им следует обратить внимание, проверяя при этом знания химических основ того производства, которое является объектом предстоящей экскурсии. На итоговом уроке рассказывают о производстве преимущественно сами учащиеся, а учитель лишь направляет беседу постановкой вопросов, делает необходимые уточнения, дополнения и обобщения. Обсуждения вопросы из числа тех, которые были даны на подготовительном уроке перед экскурсией; опрашивать при этом следует учащихся всего класса независимо от того, в состав какой группы они входили.
Подводя итоги экскурсии, учитель проверяет: а) значение сырья, используемого на предприятии, получаемого продукта, основной аппаратуры, принципов ее устройства и работы; б) понимание важнейших химических процессов, условий их осуществления и способов управления ими; в) значение основных трудовых функций работников ведущих профессий химических производств.
Чтобы приучить учащихся во время экскурсии внимательно наблюдать, следует проверять степень усвоения преимущественно экскурсионного материала. Поэтому вопросы надо формулировать так, чтобы учащиеся рассказывали обо всем, что они увидели, что узнали, в той последовательности, какой проходила экскурсия. При этом важно, чтобы ответы представляли собой подробный и связный рассказ. Учащихся следует ориентировать на то, чтобы их ответы строились преимущественно на том материале, который они непосредственно увидели на производстве, и иллюстрировались наглядными пособиями: таблицами, схемами, коллекциями, собственными схематическими зарисовками отдельных объектов.
Перед экскурсией учитель не имеет возможности останавливаться на деталях производства; поэтому в данном случае будет целесообразно ставить перед учащимися такие дополнительные вопросы, ответы на которые должны быть конкретными.
Целью второго этапа обобщающей беседы, проводимой на итоговом уроке, является анализ фактического материала, связь его с ранее изученным и выявление общего в химических производствах. Это возможно в тех случаях, когда учащиеся уже посетили одно или несколько предприятий и в классе изучили несколько отдельных производств. Для обсуждения можно предложить вопросы о том, какие аппараты, машины из тех, которые видели учащиеся на данной экскурсии, уже встречались им во время посещения других производств или при изучении в классе. В зависимости от того, на каком этапе изучения химии (экологии) находятся школьники и какова их предшествующая подготовка, они могут выявить целый ряд аппаратов, имеющих общее устройство.
Экскурсионный материал учителю следует дополнить тем материалом, который нецелесообразно было объяснять на предприятии, чтобы не удлинять экскурсию, если в процессе экскурсии не были выявлены общие принципы современного производства, а учащиеся знакомы с этим материалом по предыдущим урокам, соответствующие обобщение можно провести в процессе разбора ответов на вопросы учителя. Если эти вопросы вызывают затруднения у учащихся, то учителю самому следует выявить общие принципы производства после того, как основные фактические сведения о производстве будут повторены в классе. Освещая тот или иной принцип, непременно следует сопоставить те производства, где использование данного принципа достаточно ярко проявляется.
На протяжении всего итогового урока перед глазами учащихся должны быть общая технологическая схема производства, модели или схемы отдельных аппаратов. Желательно, эти схемы были выполнены с максимальным приближением к тем объектам, которые учащиеся наблюдали. Можно провести просмотр кинофильма, кинофрагмента, диапозитивов.
Более сложным способом подведения итогов экскурсии является ученическая конференция. Ее следует проводить за счет учебного времени как урок конференцию или во внеурочное время как внеклассное мероприятие.
Чтобы конференция прошла успешно, ее следует тщательно подготовить. Учащиеся составляют письменные рефераты, доклады на 5-7 минут, подбирают иллюстрированный материал. Учитель консультирует учащихся, рекомендует дополнительную литературу, учит с ней работать, проверяет содержание и оформление рефератов и иллюстрации к ним. Ко дню конференции можно выпустить стенгазету или бюллетень, а из иллюстративных материалов и письменных докладов подготовить выставку, отражающую результаты экскурсии. Подобная выставка материала, собранного во время экскурсии, будет не просто наглядной демонстрацией проделанной работы, но ни одним из способов накопления учебных пособий для кабинета химии. Этот материал можно применить при изучении данной темы в следующем учебном году, а также использовать для составления и решения задач с производственным содержанием. Все это способствует более глубокому изучению последующего программного материала на политехнической основе. Конференция обычно начинается кратким вступительным словом учителя. Затем с докладами выступают учащиеся. Они демонстрируют свои экспонаты, записывают формулы и уравнения на доске, используют другие приемы для объяснения положений, которые освещаются докладе. После каждого доклада учащиеся могут задать вопросы докладчику, внести поправки и дополнения. Желательно пригласить на конференцию представителя завода. Он может рассказать о перспективах развития данного производства, о характере труда, о значении общего химического и экологического образования для овладения основными профессиями химических производств, для дальнейшего технического совершенствования производства. В заключение конференции учитель проводит обобщение рассмотренного материала. Итоги экскурсии можно подвести и на специальном школьном вечере, пригласив на него специалистов завода, передовиков производства, родителей, представителей местных общественных организаций. Поскольку подготовка к таким конференциям и вечерам требует от учащихся больших затрат времени, то конференции и вечера часто проводить не следует.
Глава 3. Методические разработки
3.1 Мои уроки
Урок № 1. Экскурсия на водоочистную станцию
Экскурсия проводится в 8 классе при изучении темы "значение воды. Охрана водоемов от загрязнения". В связи с тем, что изучением этих вопросов начинается новая тема, подготовительный к экскурсии урок можно не проводить. Учителя, как правило, сразу проводят экскурсию на водоочистную станцию как урок в условиях производства объекта без предварительной подготовки учащихся в классе.Такой подход возможен потому, во-первых, данный учебный материал имеет описательный характер особых трудностей для усвоения не представляет. Во-вторых, учащиеся могли раньше уже посетить водоочистную станцию, например в 7 классе при изучении физики. Но в том случае, если учащиеся на данном объекте еще не были, то лучше провести обычный урок по химии, который станет подготовительным к экскурсии.
Экскурсию целесообразно провести как комплексную (совместно с учителем физики). По химии учащиеся получают конкретные представления о практическом значении очистки воды, о применяемых при этом веществах в процессах. По физике они закрепляют знания о свойствах жидкостей и газов, атмосферном давлении, устройстве и работе отдельных установок, машин и механизмов.
На водоочистную станцию можно провести экскурсию и при изучении темы "Галогены", когда рассматриваются свойства хлора. Восьмиклассники, которые уже усвоили сущность процесса растворения и изучили окислительные свойства хлора, глубже осознают научные основы водоочистки.
Подготовительный урок. Начинается урок с беседы, в процессе которой выясняют, что учащимся известно о воде. На уроках природоведения и географии они узнали об исключительно важном значении воды в истории развития нашей планеты. А на уроках биологии - о роли воды в жизни растительного и животного мира Земли. Учащиеся рассказывают, что вода - это одно из немногих веществ, которое в условиях Земли находится в трех агрегатных состояниях; вспоминают физические свойства воды; отмечают ее значение в технике, сельском хозяйстве, быту.
Дальнейшую беседу учитель проводит, рассматривая следующие вопросы:
1. Какие примеси содержит природная вода? 2. Как можно удалить из воды песок, глину, органические остатки? 3. Как можно избавить воду от микроорганизмов? 4. Как можно выделить из воды, растворенные в ней минеральные соли и получить совсем чистую воду? В каких случаях, и с какой целью это делается? 5. Нужно ли воду, предназначенную для питья, полностью очищать от минеральных солей?
Учащиеся правильно отвечают на большинство поставленных вопросов. На основе знаний, полученных по курсу природоведения, они указывают на применение фильтрования как способа очистки воды от взвешенных в ней мелких нерастворимых частичек. На основе жизненных наблюдений отмечают, что для уничтожения микроорганизмов воду хлорируют, как это делается с водопроводной водой.
Учитель дополняет их ответы и переходит к проблеме очистки воды, указывая, что в зависимости от того, для каких нужд очищается вода, ее очищают от примесей в различной степени. Предупреждает учащихся о предстоящей экскурсии на водоочистную станцию, где они смогут непосредственно наблюдать за процессом очистки воды.
Учитывая, что в ходе экскурсии учащиеся встретятся с аппаратами или частями сооружений и установок, раскрыть и рассмотреть которые не всегда представляются возможным, на подготовительном уроке для лучшего усвоения материала следует использовать наглядные пособия - схемы, чертежи, рисунки и др.
Экскурсия. Целесообразно экскурсию начать с осмотра водоприемного сооружения и далее осмотр отделов и аппаратов проводить в той последовательности, в которой вода проходит по водопроводу от источника до потребителя. Это облегчит учащимся усвоение устройства и работы водопроводной станции.
Экскурсовод (учитель) показывает, что на берегу или неподалеку от поверхностного водоисточника располагается водоприемное сооружение, откуда вода поднимается насосной станцией первого подъема до уровня очистных сооружений. Учитывая то, что водоприемное сооружение (береговой колодец) частично размещается под землей и водой, его устройство и работу необходимо предварительно рассмотреть на схеме.
Объясняют, что на водоочистных станциях воду сначала пропускают через мелкое сито и систему сеток, задерживающую большие плавающие предметы. Сетки автоматически очищаются от загрязнений. Чувствительный прибор, регистрирует засоренность сеток, воздействует на реле, которое включает электромоторы. Сетки с помощью моторов начинают вращаться и промываются. Как только промывание сеток закончится, другое реле закрывает задвижку промывной ванны и включает моторы, вращающие сетки.
Вода, проходящая сквозь сетки, по самотечной трубе попадает в береговой колодец. В соответствии с законом сообщающихся сосудов она располагается в береговом колодце на том же самом уровне, что и в водоисточнике (если насосы не работают). По мере того как происходит всасывание воды насосным агрегатом, ее уровень в береговом колодце немного понижается. Разница уровней воды в водоисточнике и в береговом колодце создает определенное давление (напор), действующее в направлении от водоисточника к береговому колодцу. Поэтому береговой колодец при всасывании воды из него насосами все время пополняется из водоисточника. Далее учащиеся знакомятся с насосной станцией первого подъема воды. Она располагается возле берегового колодца, а часто и соединяется с ним. Как правило, насосная станция имеет не менее трех насосных агрегатов, оборудованных насосами центробежного типа, проводящимися в действие электродвигателем. Пока один из агрегатов работает, другой в это время ремонтируется, а третий является резервным. Поэтому при необходимости (если экскурсия комплексная) учащиеся могут изучить насос, который разобран для ремонта.
После этого переходят к осмотру очистных сооружений. Обращается внимание на то, что вода поверхностного источника содержит большое количество различных примесей. Экскурсовод показывает учащимся неочищенную воду (она немного мутная) и объясняет, что на взвешенные в воде частички, кроме силы тяжести, действует архимедова сила. Поэтому в стоячей воде или при медленном ее течении частички, плотность которых меньше плотности воды, всплывают наверх, а подавляющее большинство частичек, плотность которых больше плотности воды, оседают на дно, и вода при отстаивании механически очищается от примесей.
Учащиеся переходят к бассейнам - отстойникам, а экскурсовод продолжает объяснять, что некоторые тяжелые частицы в воде не оседают. Эти частицы определенного размера; они образуют коллоидные растворы, которые весьма устойчивы. Разрушение коллоидных растворов, или коагуляцию, проводят, добавляя к воде химические реагенты. Это могут быть различные коагулянты: Fe2 (SO4) 3 7H2O; Al2 (SO4) 3 18H2O; FeCl3 6Н2О; - в виде разбавленных растворов, в которых массовая доля вещества не превышает 5-10%. Химический состав реагентов и происходящую при этом химическую реакцию восьмиклассникам не сообщают, но учителю необходимо знать, что этот процесс в общем виде моно выразить следующим образом:
Al2 (SO4) 3 +3Ca (HCO3) 2 = 2Al (OH) 3+3CaSO4+6CO2
В результате этого образуются хлопья - нерастворимые соли и основания.
Экскурсовод показывает учащимся воду с образовавшимся в ней хлопьями. Учащиеся видят, что они слипаются друг с другом, укрупняются и медленно опускаются на дно сосуда, увлекая взвешенные частички мути. Хлопья, у которых большая площадь поверхности, обладают способностью поглощать вещества, придающие воде цвет и запах.


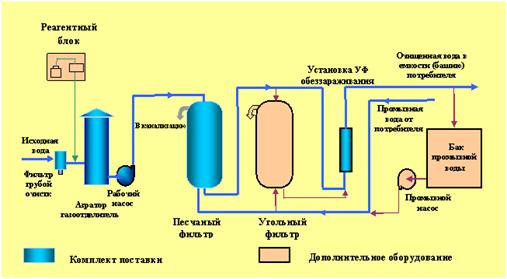
Рис.1. Схемы очистки сточных вод
Ознакомившись с принципом работы отстойника, учащиеся переходят в зал фильтров. Здесь на специальном макете экскурсовод объясняет устройство песчаного фильтра, который представляет собой железобетонный резервуар, заполненный песком, гравием и др. Экскурсовод демонстрирует примеры закрывания и открывания задвижек труб для подвода осветленной и отвода профильтрованной воды, открывание вентиля для отвода загрязненной промывочной воды в канализацию.
Работа каждого фильтра контролируется с отдельных пультов управления. Весь зал фильтров обслуживает 1-2 специалиста. При фильтровании вода просачивается через узкие каналы между песчинками. Здесь задерживаются самые мелкие хлопья и другие взвешенные частички, образуя поверхностную пленку. Как только пленка на фильтре достигает определенной плотности, приборы автоматически водят в действие промывные устройства. После промывания песка автоматы снова включают фильтр.
Вода, пошедшая сквозь фильтр, может содержать еще некоторую долю бактерий. С целью дезинфекции в воду добавляют сжиженный хлор (на 1л воды 2мг хлора). Учащиеся осматривают установки для хлорирования воды.
Если экскурсия поводится в конце 8 класса, то учащиеся знают о бактерицидном действии хлора на воду и микроорганизмы и умеют записывать уравнение реакции:
Сl2+Н2О=НСlО+НСl
НСlО®НС1+[О], 2[О]2®О или
2НСlО=2НС1+О2
Поэтому дополнительно можно лишь сообщить, что скорость разложения хлорноватистой кислоты НСlО увеличивается при освещении и а присутствии некоторых веществ, например гидрокарбоната кальция Са (НСО3) 2.
Учителю необходимо знать (этот материал можно использовать в старших классах), что из-за большой неустойчивости хлора в воде наряду с хлорированием используют и так называемую преаммонизацию воды. Она заключается в том, что при хлорировании в воду добавляют немного аммиака, так чтобы соотношение аммиака и хлора было равным 1: 4. В результате взаимодействия хлора с аммиаком образуются вещества, называемые хлораминами.
Весь процесс очистки воды длится 16 часов. Чистая вода поступает в резервуары - сборники. Отсюда насосная станция второго подъема подает воду в водопроводную сеть. Часть воды подается в водонапорную башню, за счет этого поддерживается определенное давление (напор) в водопроводной сети; эта вода служит определенным запасом, необходимым для покрытия расхода воды в часы наибольшего водозабора.
В конце экскурсии учащиеся посещают химическую лабораторию, в которой осуществляют контрольно-химический, бактериологический, гидрологический анализы. В заключении экскурсовод подчеркивает, что данные методы защиты водопроводной воды обеспечивают необходимое качество воды только в условиях незагрязненных природных источников. С развитием промышленности, химизацией сельского хозяйства, за регулирования рек значительно усложнилось использование природных источников для питьевых и промышленных целей. Технология обработки питьевой воды, которая сводится к осветлению, обесцвечиванию, обеззараживанию и проводится в основном при помощи химических реагентов, не годится для очистки воды от пестицидов, продуктов жизнедеятельности сине-зеленных водорослей и многих промышленных загрязнений.
Урок № 2. Экскурсия в пожарное депо
Противопожарная безопасность и меры ее профилактики - составная часть химических (экологических) знаний. Поэтому при изучении химии необходимо вооружать учащихся знаниями правил противопожарной безопасности и добиваться их выполнения коле, в быту, на производстве. В связи с этим важное значение приобретает организация экскурсии в пожарную часть.
Рис. 2. Схема пожарного депо
На первый взгляд может показаться, что такую экскурсию следует проводить с учащимися 8 класса, которые в теме "кислород. Оксиды горение" изучают условия возникновения и прекращения горения.
Однако это совсем не так. Дело в том, что химические процессы, происходящие при работе огнетушителей, еще не доступны пониманию восьмиклассников. Поэтому целесообразнее проводить эту экскурсию с учащимися 9 класса при изучении темы "подгруппа углерода", когда рассматривают свойства оксида углерода (4) и его применение в огнетушителях и пожарных машинах. В любом из этих случаев данную экскурсию желательно организовать как комплексную по химии, экологии и физике, потому что по курсу физики 9 класса изучают закон Бернулли и др.
Подготовительный урок
На этом уроке важно отметить, что окружающая среда несет немалый урон от пожаров и возгораний. Причиной пожаров является многие факторы, но, прежде всего - это химическая неграмотность некоторых людей, недопустимая небрежность в выполнении учебных, бытовых и производственных операций, нарушение условий общения с веществами и источниками энергии.Чтобы успешно бороться с огнем, угрожающим живой и неживой природе, нужно знать, как возникает горение. Учитель напоминает, сто первоначальные знания о горении учащиеся приобрели еще в 8 классе. Когда изучали химические свойства кислорода. Тогда же они узнали, что для начала горения необходимо горючее вещество било подведено до определенной температуры. С этой целью следует продемонстрировать горение скипидара в металлическом тигле или металлической коробке. Сначала учитель обращает внимание учащихся на то, что если к поверхности скипидара подвести горячую лучинку, то скипидар не воспламеняется. А если теперь со скипидаром предварительно нагреть, то скипидар легко загорается. Но горение сразу же прекращается, если тигель с зажженным скипидаром охладить.
Чтобы напомнить учащимся о другом условии горения - достаточном доступе воздуха, демонстрируют опыт: бензин, находящийся на дне химического стакана, зажигают, а затем стакан плотно закрывают стеклянной или картонной пластинкой. Горение сразу же прекращается.
На основе наблюдений учащиеся самостоятельно делают следующие обобщающие выводы: 1 чтобы горение началось, необходимо нагреть вещество до температуры воспламенения и обеспечить доступ кислорода к нему.2 чтобы горение прекратилось, необходимо вещество охладить или прекратить доступ кислорода.
Затем разбирают случаи горения разных веществ в атмосфере хлора, фтора и таким образом, приходят к важному обобщению: горением называют такую химическую реакцию, которая сопровождается выделением тепла и света.
Урок № 3. Экскурсия в отопительную котельную
Эту экскурсию целесообразно провести в IX классе как комплексную по химии и физике: при изучении темы по химии "Подгруппа углерода", в которой рассматриваются вопросы об основных видах топлива и способах сжигания твердого, жидкого и газообразного топлива, и при изучении темы по физике "Теплопередача и работа".Подготовительный урок. Повторяют свойства кислорода и сущность реакции окисления, обращают внимание на продукты' горения сложных веществ, отмечают важную роль огня в развитии цивилизации, рассматривают существенные признаки реакции горения, дают ее определение. Затем учащиеся, пользуясь коллекцией "Топливо", выполняют лабораторный опыт "Ознакомление с различными видами топлива, характеризуют виды топлива, отмечают их значение.
Учитель предупреждает учащихся об экскурсии в отопительную котельную, и дается задание: ознакомиться со схемой простейшего устройства для сжигания топлива. Если используется пылевидное топливо, то его сжигают с помощью форсунки.
Чтобы учащиеся имели представление о строении форсунки, учитель предлагает, используя учебник, вспомнить аналогичное устройство ацетиленокислородной горелки. Для распыления жидкого топлива в форсунках используют водяной пар пли сжатый воздух. Лучше всего смешивается с воздухом и полнее сгорает газообразное топливо.
Учитель рассказывает, где используется жидкое и газообразное топливо. Учащиеся делают вывод, что во время горения топлива происходит химическая реакция между горючими веществами, входящими в состав топлива, и кислородом воздуха, сопровождающаяся выделением теплоты и света.
Экскурсия. Комплексная экскурсия проводится по следующему плану:
1) ознакомление с отопительной котельной;
2) ознакомление с устройством и принципом работы системы отопления зданий. При проведении тематической экскурсии можно ограничиться осмотром котельной.
В ходе предварительной беседы экскурсовод или учитель сообщает учащимся, какой вид топлива используется в данной котельной, чему равна удельная теплота сгорания данного топлива и переводной коэффициент к условному топливу. Из курса физики учащиеся знают, что для сравнения качества различных видов топлива введено понятие "условное топливо", удельная теплота сгорания которого составляет 29 300 Кдж/кг.
После вступительной беседы переходят в помещение, в котором находится котельная установка. Оператор (кочегар) показывает учащимся приемы обслуживания топки: загружает топку топливом, изменяет силу дутья, при помощи рукоятки покачивает колосником. Экскурсовод объясняет, что во время эксплуатации топки на колосниковой решетке образуются три слоя. Свежее топливо образует верхний горючий слой, из которого под влиянием высокой температуры выделяются горючие газы и другие летучие вещества. Горючие газы сгорают в топочном пространстве красным или светло-желтым пламенем. После испарения летучих веществ остается горючий кокс. Он составляет средний слой. В результате сгорания кокса образуются зола и шлак, которые располагаются в нижнем слое и постепенно проваливаются через колосниковую решетку в зольник или шлаковый бункер. Периодически золу и шлак выгружают из бункера через шлаковый затвор. Воздух, необходимый для поддержания горения, поступает из атмосферы через подколосниковое пространство (поддувало) и вдувается вентилятором через диффузор.
Экскурсовод объясняет учащимся, как обеспечивается полнота сгорания топлива. В процессе горения топливо реагируеТ1 с кислородом воздуха в определенном количественном отношении. Чтобы сгорание происходило полнее, воздух подают в топку в не котором избытке по сравнению с теоретически необходимым. Чрезмерный избыток воздуха также нежелателен, ибо увеличивается расход теплоты на его нагревание.
Оператор котельной отмечает признаки неполного сгорания топлива и показывает, как этого можно избежать: усиливает дутье, прочищает колосники от золы, удаляет шлак. При правильно соблюдаемом отношении масс топлива и воздуха сгорание происходит практически полностью. Признаками полного сгорания топлива являются светло-желтое (соломенное) пламя в топке и бледнокоричневый дым. При этом в топке достигается высокая температура (при сгорании дров - 950-1100°С, угля - 1100-1300 °С, мазута - 1400-1500°С, природного газа - до 16000С).
Учащимся предлагается через глазок (смотровое окошко) заглянуть внутрь топки, рассмотреть пламя, которое образуется при сгорании топлива, и определить, полностью ли оно сгорает.
В заключение можно отметить, что топки для сжигания других видов топлива отличаются по своей конструкции. Так, для сжигания торфа и дров применяют шахтные топки, имеющие больший объем топочного пространства. Колосниковая решетка в них расположена наклонно, чтобы топливо по ней непрерывно перемещалось по мере горения, а решетка самоочищалась от золы.
Итоговый урок. При подведении итогов экскурсии не следует повторять устройство топок для сжигания топлива, эти сведения даются ознакомительно. Главное, чтобы учащиеся поняли, что во всех случаях при сжигании топлива необходимо придерживаться правильного массового или объемного топлива и обеспечивать хорошее их перемешивание.
В заключение повторяют, в чем заключается основное содержание труда оператора котельной установки, делают вывод о необходимости знаний по химии для успешного выполнения этих трудовых функций, подчеркивают значимость данной рабочей профессии в сфере производства, обеспечивающей народное хозяйство тепловой энергией, правильного использования энергии сгоревшего топлива, экономии топливно-энергетических ресурсов, охраны атмосферы от загрязнений [1, 9-12].
Последовательность выполнения работы
1. В лабораторный стакан емкостью 500 мл налейте 400 мл водопроводной воды и внесите в нее перечисленные ниже загрязняющие вещества:
столовая ложка почвы;
несколько капель или кристалликов пищевого красителя;
около 1 мл прокисшего молока или мясного бульона, содержащего бактерии.
К" каким типам загрязнителей относятся названные вещества?
Присутствие в воде этих веществ заметно по ее относительной мутности. Исследуйте эффективность различных способов очистки для устранения загрязнителей.
2. Отстаивание.
Налейте 50 мл загрязненной воды в мерный цилиндр. Наблюдайте за происходящими изменениями в течение 0,5-1 ч.
Какие из загрязняющих веществ можно удалить отстаиванием? Исследуйте верхний слой волы на загрязнение следуюшими способами:
присутствие в воде взвесей определяется ее относительной мутностью (прозрачная вода взвесей практически не содержит);
присутствие растворенных веществ в данном случае определяется визуально, поскольку нами был использован пищевой краситель;
присутствие бактерий проверяется с помощью стерильной проволочной петли: петлю простерилизуйте в пламени; перенесите каплю исследуемой воды из стакана в чашку Петри с заранее приготовленной питательной средой - эта среда обеспечивает рост бактерий, так что их присутствие будет заметно по появлению колоний через несколько дней.
3. Фильтрование.
Отфильтруйте с помощью воронки и фильтровальной бумаги 20-30 мл загрязненной воды в чистый лабораторный стакан. Проверьте отфильтрованную воду на загрязнение описанными выше способами.
Удаляются ли в результате фильтрования взвеси? Растворенные вещества? Бактерии? Сравните эффективность отстаивания и фильтрования.
4. Хлорирование.
Налейте 30-40 мл загрязненной воды в лабораторный стакан емкостью 100 мл. Добавьте несколько капель раствора хлорки, тщательно перемешайте и дайте отстояться в течение 10 мин. Проверьте воду на загрязнения.
Удаляются ли в результате хлорирования взвеси? Растворенные вещества? Бактерии? Почему в настоящее время особую актуальность приобретают разработки технологий обеззараживания волы без применения хлора?
4. Дистилляция.
Пронаблюдайте за процессом дистилляции воды.
Удаляются ли в результате дистилляции взвеси? Растворенные вещества? Бактерии? Почему дистилляцию не используют как единственный способ надежной очистки питьевой воды?
Проба с простейшими
Для опытов берут культуру простейших, приготовленную заранее.
а) Висячую каплю культуры простейших помещают над часовым стеклом с кашицей или вытяжкой исследуемого материала, чтобы они не соприкасались и, наблюдая в микроскоп при увеличении 300 или 600 (в зависимости от цели), отмечают по секундомеру время прекращения движения простейших.
Фитоцидную активность (А) выражают в единицах, рассчитанных по формуле, где Т - время.
А = 100: Т
Картина гибели простейших под влиянием фитонцидов разных растений различна. Это - растворение (лизис), образование вздутий и пузырей, сморщивание, просто прекращение движения и т.д.
б) В каплю культуральной жидкости с простейшими в середине часового стекла добавляют меньшую каплю вытяжки растений с сильной фитонцидной активностью. Наблюдают сначала усиление движения, затем избегание простейшими фитонцидной вытяжки (рассредоточение по краям), далее обнаруживаются уменьшение и вовсе прекращение движения.
Через некоторое время можно видеть и морфологические изменения, указанные в предыдущем разделе данной работы.
Для исключения растекания капли вытяжки ее место можно ограничить, сделав предварительно на предметном стекле петлю из человеческого волоса, в которую и помещают каплю культуральной жидкости.

Простейшие - обитатели воды: А - жгутиковые, Б - амебы, В - инфузории [11].
гидроксид бария;
гидроксид железа (II); +
гидроксид натрия;
гидрокарбонат аммония
Гидроксид цинка может реагировать со всеми веществами пары:
сульфат кальция и оксид серы (VI);
гидроксид натрия (р-р) и соляная кислота; +
вода и хлорид натрия;
сульфат бария и гидроксид железа (III).
В молекулярном уравнении реакции гидроксида цинка с соляной кислотой сумма всех коэффициентов равна:
1) 72) 5+3) 64) 4
Сумма коэффициентов в молекулярном уравнении реакций между гидроксидом алюминия и соляной кислотой равна:
1) 72) 8 +3) 64) 4
Формулы только основных оксидов указаны в ряду: 2O, SO2, CaO;
K2O, Na2O, CaO; +; CO, SO3, P2O5; CO, SO2, K2O.
Реакция
FeCl3 + 3NaOH ® Fe (OH) 3 + 3NaCl
относится к реакциям:
соединения;
разложения;
замещения;
обмена. +
При обычных условиях основания можно получить при взаимодействии с водой: BaO, CuO, FeO; Na2O, CaO, Li2O; +;MgO, ZnO, Al2O3; K2O, Li2O, Mn2O7.
Количеству вещества 1,5 моль равна масса гидроксида меди (II):
1) 98 г;
2) 196 г;
3) 147 г; +4) 980 г.
Реакции гидроксида железа (II) с серной кислотой отвечает сокращенное ионное уравнение:
FeO + 2H+ ® Fe2+ + H2O;
Fe (OH) 3 + 3H+ ® Fe3+ + 3H2O;
Fe (OH) 2 + 2H+ ® Fe2+ + 2H2O; +
Fe2+ + 2OH - ® Fe (OH) 2.
Основные свойства проявляет оксид:
марганца (VII);
кальция; +
калия; +
серы (IV), фосфора.
В схеме превращений:

веществами А, Б, В являются соответственно: Cl2, H2O, Na2O; HCl, NaOH, NaOH (избыток); +HCl, H2O, NaOH; Cl2, NaOH, Na2O.
Характер реакции среды водного раствора аммиака:
слабокислый;
сильнокислый;
нейтральный;
щелочной. +
Гидроксид алюминия проявляет амфотерные свойства при взаимодействии:
только с щелочью;
с кислотой и щелочью; +
только с кислотой;
с солью и кислотой
Раствор гидроксида натрия реагирует с каждым из веществ, указанных в паре:
оксид железа (II) и соляная кислота; +
хлорид железа (III) и углекислый газ;
серная кислота и оксид кальция;
оксид цинка и хлорид калия.
Конечным продуктом в цепочке превращений на основе цинка является:

гидроксид цинка;
оксид цинка; +
цинк;
цинкат калия
В сокращенном ионном уравнении реакции серной кислоты с гидроксидом натрия сумма коэффициентов равна:
1) 7;
2) 5;
3) 3; +4) 4.
Раствор гидроксида натрия взаимодействует с каждым веществом, указанным в ряду:
оксид кремния, сульфат натрия, хлоргидроксид алюминия;
оксид железа (II), медь, серная кислота, гидроксид алюминия;
оксид кремния, алюминий, соляная кислота, гидроксид цинка; +
оксид железа (II), медь, аммиак, гидроксид цинка.
В водном растворе ступенчато диссоциируют:
1) KOH;
2) Cu (OH) 2;
3) Ca (OH) 2; +4) Al (OH) 3.
Общая сумма всех коэффициентов в полном и сокращенном ионном уравнениях реакции между нитратом серебра и гидроксидом натрия равна ____________________ (ответ напишите цифрами- 10)
Гидроксид бария можно получить из
BaO и H2CO3;
BaSO4 и NaOH;
BaO и NaOH
BaO и Н2О+
Установите соответствие:
Щелочь, а затем кислоту используют при осуществлении следующих превращений:
CaO ® CaCO3 ® CO2;
FeCl2 ® Fe (OH) 2 ® FeSO4; +
K ® KOH ® K2SO4;
CuSO4 ® Cu (OH) 2 ® CuO.
Сокращенным ионным уравнением Fe2+ + 2OH - = Fe (OH) 2¯ может быть выражено взаимодействие между:
FeO + KOH;
FeCl2 + NaOH; +
FeSO4 + Cu (OH) 2.
Сокращенным ионным уравнением NH4+ + OH - Û NH3 + H2O
можно выразить результат взаимодействия веществ:
хлорида аммония и гидроксида натрия; +
хлорида аммония и нитрата серебра;
аммиака и соляной кислоты;
сульфата аммония и гидроксида меди (II).
Сильными электролитами являются все вещества группы: KOH, HNO3, H2SO4; + H2S, H2SO3, H2SO4; MgCl2, CH3COOH, NaOH; H2S, CH3COOH, H2SO3.
Отметьте самый сильный электролит:
1) RbOH; +2) Ca (OH) 2;
3) CuOH;
4) LiOH.
Как изменяются свойства гидроксидов, образованных металлами главной подгруппы II группы, при увеличении заряда ядра атомов?
щелочи ® нерастворимое основание ® амфотерный гидроксид;
амфотерный гидроксид ® нерастворимое основание ® щелочь;
кислота ® амфотерный гидроксид ® щелочи;
основания ® амфотерный гидроксид ® кислота. +
Основные свойства гидроксидов усиливаются слева направо в ряду
Mg (OH) 2 - Al (OH) 3 - H2SiO3 - H3PO4
H2CO3 - B (OH) 3 - Be (OH) 3 - LiOH+
NaOH - Mg (OH) 2 - H3PO4 - H2SO4
LiOH - B (OH) 3 - H2CO3 - HNO3
Будет протекать реакция в растворе между гидроксидом калия и
1) NO2;
2) Fe2O3; +3) BaSO4;
4) Ca (OH) 2
Установите соответствие:
Сокращенное ионное уравнение Zn2+ + 2OH - = Zn (OH) 2¯ отражает сущность взаимодействия между:
цинком и водой;
оксидом цинка и водой;
хлоридом цинка и гидроксидом натрия; +
хлоридом цинка и серной кислотой.
При взаимодействии 40 г гидроксида натрия и 100 г сульфата меди (II) масса вещества, оставшегося в избытке, равна___ г. (80г CuSO4)
33. Укажите название кислоты, которая может образовывать кислые соли:
а) метафосфорная
б) азотная
в) угольная +
г) уксусная
34. Два типа кислых солей образует кислота:
а) угольная
б) сернистая
в) сероводородная
г) ортофосфорная +
35. У каких солей заряд кислотного остатка равен - 1:
а) сульфид натрия
б) гидросульфит кальция +
в) дигидрофосфат натрия +
г) гидросульфат калия +
36. Какие вещества, реагируя с раствором хлорида бария, образуют соль?
а) азотная кислота
б) серная кислота
в) сульфат натрия +
г) карбонат калия
37. Какие металлы вытесняют медь из водного раствора сульфата меди (II):
а) железо +
б) серебро
в) натрий
г) цинк +
38. Заряд каких кислотных остатков равен - 2?
а) гидрокарбонат-ион
б) гидрофосфат - ион +
в) дигидрофосфат-ион
г) сульфит-ион +
39. В отличие от соляной кислоты концентрированная серная кислота при определенных условиях может реагировать с:
а) гидроксидом калия
б) нитратом натрия +
в) оксидом алюминия
г) оксидом углерода (IV)
40. Ортофосфорная кислота реагирует с:
а) оксидом кальция +
б) хлоридом натрия +
в) гидроксидом железа +
г) оксидом кремния (IV)
41. В каких парах вещества могут реагировать между собой?
а) серная кислота и карбонат калия +
б) нитрат серебра и ортофосфорная кислота +
в) соляная кислота и железо +
г) оксид алюминия и азотная кислота +
42. С какими из перечисленных веществ реагируют щелочи?
а) растворимыми солями меди +
б) слабыми кислотами +
в) основными оксидами
г) амфотерными гидроксидами +
43. Щелочь может образовываться при взаимодействии?
а) калия и воды +
б) карбоната натрия и гидроксида бария (водные растворы) +
в) хлорида алюминия и гидроксида аммония (водные растворы)
г) оксида натрия и воды +
44. Щелочи могут реагировать:
а) только с сильными кислотами
б) как с сильными, так и со слабыми кислотами +
в) только с кислотными оксидами
г) как с кислотными, так и с амфотерными оксидами +
45. Основание не образуется при взаимодействии избытка разбавленного раствора щелочи с:
а) сульфатом алюминия +
б) хлоридом железа (II)
в) нитратом аммония
г) хлоридом цинка +
46. При нагревании сравнительно легко разлагаются:
а) гидроксид калия
б) гидроксид меди (II) +
в) гидроксидом натрия
г) гидроксидом алюминия +
47. Охарактеризуйте свойства оксида кремния (IV):
а) амфотерный
б) кислотный +
в) не реагирует с водой +
г) вытесняет при нагревании из кристаллических карбонатов оксид углерода (IV)
48. Оксид фосфора (V) не реагируют с:
а) водой
б) щелочами
в) основными оксидами
г) кислотами +
49. С какими веществами, формулы которых приведены ниже, реагирует 
, но не реагирует 
?
а) оксид бария +
б) вода
в) серная кислота
г) гидроксид натрия +
50. Наиболее выраженными кислотными свойствами обладает:
а) оксид висмута (V)
б) оксид фосфора (V)
в) оксид азота (V) +
г) оксид мышьяка (V) [27-30].
В экспериментальных классах были проведены разработанные уроки - экскурсии, приведенные в главе 3. Занятия проводились с акцентом на прикладные и экологические аспекты.
Для констатации результата после проведения разработанных занятий были проведены контрольные работы, состоящие из тестов, которые приведены в главе III. Результаты эксперимента в школе приведены на диаграмме, отражающей изменения качества знаний и успеваемости в контрольном (8 а) и экспериментальном (8 в) классах.

Диаграмма 1. Изменение успеваемости учащихся
Таким образом, избранная тематика способствовала повышению качества знаний, научного и экологического мировоззрения, а главное вызвала интерес учащихся к более глубокому изучению химии.
На основе проведенной работы можно сделать следующие выводы:
1. Доказано, что использование на уроках химии экскурсий с акцентом на экологические знания развивает умения наблюдать факты и явления и объяснять их сущность в свете изученных теорий и законов; формирует и совершенствует экспериментальные умения и навыки.
2. Оценен уровень сформированности знаний и познавательной активности при изучении заданной темы по разработанным методическим подходам.
Изучив проблему использования экскурсий для формирования экологического мировоззрения школьников, мы можем утверждать, что гипотеза "Систематическое использование экскурсий на уроках химии способствует развитию мыслительной деятельности, познавательного интереса учащихся, более прочному и глубокому усвоению материала и формированию экологического мировоззрения и профориентации", подтверждена в ходе эксперимента.
2. Оржековский П.А. Формирование у учащихся опыта творческой деятельности при обучении химии. - М.: 1997. С.121.
3. Теоретические основы содержания общего среднего образования / Под ред.В. В. Краевского, И.Я. Лернера. - М.: 1983. С.211.
4. Сафонова М.В. Экскурсии на химические производства. - М.: 1998.
5. Бабанский Ю.К. Об актуальных проблемах совершенствования обучения в общеобразовательной школе // Советская педагогика, 1979, № 3. С.3-10.
6. Чернобельская Г.М., Трухина М.Д., Шелехова Л.М. Пропедевтический курс химии с прикладным содержанием для VIIIкласса // Химия в школе, 1995, № 4.С. 19.
7. Назаренко В.М. Химия, экология, нравственность: проблемы образования // Химия в школе, 1995, № 3. С. 2.
8. Макареня А.А., Обухов В.Л. Методология химии. - М.: Просвещение, 1985.
9. Бабанский Ю.К. Оптимизация процесса обучения. - М.: Педагогика, 1977.
10. Вивюрский В.Я. Заключительные уроки по химии в средней школе. - М.: Просвещение, 1980.
11. Производственные экскурсии по химии: Сб. статей из опыта учителей/ Под ред. Л.А. Цветкова. - М. Учпедгиз, 1953. - с.135.
12. Митлена Э.М. Создание эмоционального настроя учащихся на уроках. Химия в школе, 1989, № 6.
13. Яншин А.Л., Мелуа А.И. Уроки экологических просчетов. М.: Мысль - 1991.
14. Шиленков Р.В., Чернобельская Г.М. Развитие самостоятельности учащихся в условиях индивидуализации обучения // Химия в школе. - 2004. - №5. - с.18-19.
15. Соколова О.Е. Технология педагогических мастерских: развитие творческих способностей учащихся // Химия в школе. - 2001. - №7. - с.14-15.
16. Зайцев О.С. Методика обучения химии: Теоретический и прикладной аспекты. - М.: Гуманит. изд. ВЛАДОС, 1999. - 358 с.
17. Обучение химии в 11 классе. В 2 ч. Ч 1: Кн. Для учителя / Под ред. И.Н. Черткова. - М.: просвещение, 1992. - с.6 - 20.
18. Боброва О.В. Организация самостоятельной работы учащихся при изучении нового материала // Химия в школе. - 1996. - №5. - с.23.
19. Эпштейн Д.А. Общая химическая технология. - М.: Химия, 1979. - с.312.
20. Монахова В.М., Орлова В.А. Теория и практика проведения факультативных занятий. - М.: Просвещение, 1983. - С.150.
21. Дьякович С.В. Методика факультативных занятий по химии. - М.: Просвещение, 1985. - С.175.
22. Пидкасистый П.И. Самостоятельная деятельность учащихся. - М.: Педагогика, 1972. - С. 200.
23. Скаткина М.Н. Дидактика средней школы. - М.: Просвещение, 1982. - С.180.
24. Егорова H.В. Наш подход к экологическому образованию учащихся // Химия в школе. - 2002. - № 5. - С.40 - 43.
25. Табуева Э.М. Экологическое образование как фактор формирования культурного потенциала личности // Химия в школе. - 2004. - №5. - С.18-19.
26. Шиленков Р.В., Чернобельская Г.М. Развитие самостоятельности учащихся в условиях индивидуализации обучения // Химия в школе. - 2004. - №5. - С.18-19.
27. Кирюшкин Д.М., В.С. Полосин. Методика обучения химии. - М.: Просвещение, 1970. - C.297 - 302.
28. Эпштейн Д.А. Факультативные занятия по химии. - М.: Просвещение, 1971. - С.175.
29. Афонина И.Г. Тестовые задания в курсе химии. // Химия в школе. - 2002. - № 7. - С.43 - 45.
30. Химия: Сборник тестовых заданий для подготовки к итоговой аттестации (варианты и ответы, решение расчетных задач).9 класс (базовый уровень) / Н.В. Ширшина. - Волгоград.: Учитель, 2004. - С.81.
В заключение можно отметить, что топки для сжигания других видов топлива отличаются по своей конструкции. Так, для сжигания торфа и дров применяют шахтные топки, имеющие больший объем топочного пространства. Колосниковая решетка в них расположена наклонно, чтобы топливо по ней непрерывно перемещалось по мере горения, а решетка самоочищалась от золы.
Итоговый урок. При подведении итогов экскурсии не следует повторять устройство топок для сжигания топлива, эти сведения даются ознакомительно. Главное, чтобы учащиеся поняли, что во всех случаях при сжигании топлива необходимо придерживаться правильного массового или объемного топлива и обеспечивать хорошее их перемешивание.
В заключение повторяют, в чем заключается основное содержание труда оператора котельной установки, делают вывод о необходимости знаний по химии для успешного выполнения этих трудовых функций, подчеркивают значимость данной рабочей профессии в сфере производства, обеспечивающей народное хозяйство тепловой энергией, правильного использования энергии сгоревшего топлива, экономии топливно-энергетических ресурсов, охраны атмосферы от загрязнений [1, 9-12].
3.2 Лабораторные работы
Лабораторная работа № 1. "Моделирование этапов очистки воды"
Цель - смоделировать различные способы очистки воды и определить их эффективность в отношении различных типов загрязнителей.Последовательность выполнения работы
1. В лабораторный стакан емкостью 500 мл налейте 400 мл водопроводной воды и внесите в нее перечисленные ниже загрязняющие вещества:
столовая ложка почвы;
несколько капель или кристалликов пищевого красителя;
около 1 мл прокисшего молока или мясного бульона, содержащего бактерии.
К" каким типам загрязнителей относятся названные вещества?
Присутствие в воде этих веществ заметно по ее относительной мутности. Исследуйте эффективность различных способов очистки для устранения загрязнителей.
2. Отстаивание.
Налейте 50 мл загрязненной воды в мерный цилиндр. Наблюдайте за происходящими изменениями в течение 0,5-1 ч.
Какие из загрязняющих веществ можно удалить отстаиванием? Исследуйте верхний слой волы на загрязнение следуюшими способами:
присутствие в воде взвесей определяется ее относительной мутностью (прозрачная вода взвесей практически не содержит);
присутствие растворенных веществ в данном случае определяется визуально, поскольку нами был использован пищевой краситель;
присутствие бактерий проверяется с помощью стерильной проволочной петли: петлю простерилизуйте в пламени; перенесите каплю исследуемой воды из стакана в чашку Петри с заранее приготовленной питательной средой - эта среда обеспечивает рост бактерий, так что их присутствие будет заметно по появлению колоний через несколько дней.
3. Фильтрование.
Отфильтруйте с помощью воронки и фильтровальной бумаги 20-30 мл загрязненной воды в чистый лабораторный стакан. Проверьте отфильтрованную воду на загрязнение описанными выше способами.
Удаляются ли в результате фильтрования взвеси? Растворенные вещества? Бактерии? Сравните эффективность отстаивания и фильтрования.
4. Хлорирование.
Налейте 30-40 мл загрязненной воды в лабораторный стакан емкостью 100 мл. Добавьте несколько капель раствора хлорки, тщательно перемешайте и дайте отстояться в течение 10 мин. Проверьте воду на загрязнения.
Удаляются ли в результате хлорирования взвеси? Растворенные вещества? Бактерии? Почему в настоящее время особую актуальность приобретают разработки технологий обеззараживания волы без применения хлора?
4. Дистилляция.
Пронаблюдайте за процессом дистилляции воды.
Удаляются ли в результате дистилляции взвеси? Растворенные вещества? Бактерии? Почему дистилляцию не используют как единственный способ надежной очистки питьевой воды?
Проба с простейшими
Для опытов берут культуру простейших, приготовленную заранее.
а) Висячую каплю культуры простейших помещают над часовым стеклом с кашицей или вытяжкой исследуемого материала, чтобы они не соприкасались и, наблюдая в микроскоп при увеличении 300 или 600 (в зависимости от цели), отмечают по секундомеру время прекращения движения простейших.
Фитоцидную активность (А) выражают в единицах, рассчитанных по формуле, где Т - время.
А = 100: Т
Картина гибели простейших под влиянием фитонцидов разных растений различна. Это - растворение (лизис), образование вздутий и пузырей, сморщивание, просто прекращение движения и т.д.
б) В каплю культуральной жидкости с простейшими в середине часового стекла добавляют меньшую каплю вытяжки растений с сильной фитонцидной активностью. Наблюдают сначала усиление движения, затем избегание простейшими фитонцидной вытяжки (рассредоточение по краям), далее обнаруживаются уменьшение и вовсе прекращение движения.
Через некоторое время можно видеть и морфологические изменения, указанные в предыдущем разделе данной работы.
Для исключения растекания капли вытяжки ее место можно ограничить, сделав предварительно на предметном стекле петлю из человеческого волоса, в которую и помещают каплю культуральной жидкости.

Простейшие - обитатели воды: А - жгутиковые, Б - амебы, В - инфузории [11].
3.3 Тестовые задания
Среди перечисленных веществ отметьте нерастворимое основание:гидроксид бария;
гидроксид железа (II); +
гидроксид натрия;
гидрокарбонат аммония
Гидроксид цинка может реагировать со всеми веществами пары:
сульфат кальция и оксид серы (VI);
гидроксид натрия (р-р) и соляная кислота; +
вода и хлорид натрия;
сульфат бария и гидроксид железа (III).
В молекулярном уравнении реакции гидроксида цинка с соляной кислотой сумма всех коэффициентов равна:
1) 72) 5+3) 64) 4
Сумма коэффициентов в молекулярном уравнении реакций между гидроксидом алюминия и соляной кислотой равна:
1) 72) 8 +3) 64) 4
Формулы только основных оксидов указаны в ряду: 2O, SO2, CaO;
K2O, Na2O, CaO; +; CO, SO3, P2O5; CO, SO2, K2O.
Реакция
FeCl3 + 3NaOH ® Fe (OH) 3 + 3NaCl
относится к реакциям:
соединения;
разложения;
замещения;
обмена. +
При обычных условиях основания можно получить при взаимодействии с водой: BaO, CuO, FeO; Na2O, CaO, Li2O; +;MgO, ZnO, Al2O3; K2O, Li2O, Mn2O7.
Количеству вещества 1,5 моль равна масса гидроксида меди (II):
1) 98 г;
2) 196 г;
3) 147 г; +4) 980 г.
Реакции гидроксида железа (II) с серной кислотой отвечает сокращенное ионное уравнение:
FeO + 2H+ ® Fe2+ + H2O;
Fe (OH) 3 + 3H+ ® Fe3+ + 3H2O;
Fe (OH) 2 + 2H+ ® Fe2+ + 2H2O; +
Fe2+ + 2OH - ® Fe (OH) 2.
Основные свойства проявляет оксид:
марганца (VII);
кальция; +
калия; +
серы (IV), фосфора.
В схеме превращений:
веществами А, Б, В являются соответственно: Cl2, H2O, Na2O; HCl, NaOH, NaOH (избыток); +HCl, H2O, NaOH; Cl2, NaOH, Na2O.
Характер реакции среды водного раствора аммиака:
слабокислый;
сильнокислый;
нейтральный;
щелочной. +
Гидроксид алюминия проявляет амфотерные свойства при взаимодействии:
только с щелочью;
с кислотой и щелочью; +
только с кислотой;
с солью и кислотой
Раствор гидроксида натрия реагирует с каждым из веществ, указанных в паре:
оксид железа (II) и соляная кислота; +
хлорид железа (III) и углекислый газ;
серная кислота и оксид кальция;
оксид цинка и хлорид калия.
Конечным продуктом в цепочке превращений на основе цинка является:
гидроксид цинка;
оксид цинка; +
цинк;
цинкат калия
В сокращенном ионном уравнении реакции серной кислоты с гидроксидом натрия сумма коэффициентов равна:
1) 7;
2) 5;
3) 3; +4) 4.
Раствор гидроксида натрия взаимодействует с каждым веществом, указанным в ряду:
оксид кремния, сульфат натрия, хлоргидроксид алюминия;
оксид железа (II), медь, серная кислота, гидроксид алюминия;
оксид кремния, алюминий, соляная кислота, гидроксид цинка; +
оксид железа (II), медь, аммиак, гидроксид цинка.
В водном растворе ступенчато диссоциируют:
1) KOH;
2) Cu (OH) 2;
3) Ca (OH) 2; +4) Al (OH) 3.
Общая сумма всех коэффициентов в полном и сокращенном ионном уравнениях реакции между нитратом серебра и гидроксидом натрия равна ____________________ (ответ напишите цифрами- 10)
Гидроксид бария можно получить из
BaO и H2CO3;
BaSO4 и NaOH;
BaO и NaOH
BaO и Н2О+
Установите соответствие:
| Реагенты | Протекает реакция |
| 1. Са (ОН) 2 ® (t) … 2. NaHCO3 + NaOH (p) ® … 3. Al2O3 + Na2O ® (t) … 4. Al + H2O ® … 5. (CuOH) NO3 + HNO3 ® … 6. PbCl2 + HI ® … | А. Соединения (3) Б. Замещения (4) В. Разложения (1) Г. Нейтрализации Д. Ионного обмена (2, 5,6) |
CaO ® CaCO3 ® CO2;
FeCl2 ® Fe (OH) 2 ® FeSO4; +
K ® KOH ® K2SO4;
CuSO4 ® Cu (OH) 2 ® CuO.
Сокращенным ионным уравнением Fe2+ + 2OH - = Fe (OH) 2¯ может быть выражено взаимодействие между:
FeO + KOH;
FeCl2 + NaOH; +
FeSO4 + Cu (OH) 2.
Сокращенным ионным уравнением NH4+ + OH - Û NH3 + H2O
можно выразить результат взаимодействия веществ:
хлорида аммония и гидроксида натрия; +
хлорида аммония и нитрата серебра;
аммиака и соляной кислоты;
сульфата аммония и гидроксида меди (II).
Сильными электролитами являются все вещества группы: KOH, HNO3, H2SO4; + H2S, H2SO3, H2SO4; MgCl2, CH3COOH, NaOH; H2S, CH3COOH, H2SO3.
Отметьте самый сильный электролит:
1) RbOH; +2) Ca (OH) 2;
3) CuOH;
4) LiOH.
Как изменяются свойства гидроксидов, образованных металлами главной подгруппы II группы, при увеличении заряда ядра атомов?
щелочи ® нерастворимое основание ® амфотерный гидроксид;
амфотерный гидроксид ® нерастворимое основание ® щелочь;
кислота ® амфотерный гидроксид ® щелочи;
основания ® амфотерный гидроксид ® кислота. +
Основные свойства гидроксидов усиливаются слева направо в ряду
Mg (OH) 2 - Al (OH) 3 - H2SiO3 - H3PO4
H2CO3 - B (OH) 3 - Be (OH) 3 - LiOH+
NaOH - Mg (OH) 2 - H3PO4 - H2SO4
LiOH - B (OH) 3 - H2CO3 - HNO3
Будет протекать реакция в растворе между гидроксидом калия и
1) NO2;
2) Fe2O3; +3) BaSO4;
4) Ca (OH) 2
Установите соответствие:
| Реагенты | Сумма коэффициентов в кратком ионном уравнении |
| 1. NaHSO3 + HCl ® … 2. K2CO3 + H2O + CO2 ® … 3. Cr (OH) 3 + HBr ® … 4. Mn (OH) 2 + KHSO4 ® … | А.3 (1) Д.7 Б.4 (3) Е.8 В.5 (2) Ж.9 Г.6 (4) З.10 |
цинком и водой;
оксидом цинка и водой;
хлоридом цинка и гидроксидом натрия; +
хлоридом цинка и серной кислотой.
При взаимодействии 40 г гидроксида натрия и 100 г сульфата меди (II) масса вещества, оставшегося в избытке, равна___ г. (80г CuSO4)
33. Укажите название кислоты, которая может образовывать кислые соли:
а) метафосфорная
б) азотная
в) угольная +
г) уксусная
34. Два типа кислых солей образует кислота:
а) угольная
б) сернистая
в) сероводородная
г) ортофосфорная +
35. У каких солей заряд кислотного остатка равен - 1:
а) сульфид натрия
б) гидросульфит кальция +
в) дигидрофосфат натрия +
г) гидросульфат калия +
36. Какие вещества, реагируя с раствором хлорида бария, образуют соль?
а) азотная кислота
б) серная кислота
в) сульфат натрия +
г) карбонат калия
37. Какие металлы вытесняют медь из водного раствора сульфата меди (II):
а) железо +
б) серебро
в) натрий
г) цинк +
38. Заряд каких кислотных остатков равен - 2?
а) гидрокарбонат-ион
б) гидрофосфат - ион +
в) дигидрофосфат-ион
г) сульфит-ион +
39. В отличие от соляной кислоты концентрированная серная кислота при определенных условиях может реагировать с:
а) гидроксидом калия
б) нитратом натрия +
в) оксидом алюминия
г) оксидом углерода (IV)
40. Ортофосфорная кислота реагирует с:
а) оксидом кальция +
б) хлоридом натрия +
в) гидроксидом железа +
г) оксидом кремния (IV)
41. В каких парах вещества могут реагировать между собой?
а) серная кислота и карбонат калия +
б) нитрат серебра и ортофосфорная кислота +
в) соляная кислота и железо +
г) оксид алюминия и азотная кислота +
42. С какими из перечисленных веществ реагируют щелочи?
а) растворимыми солями меди +
б) слабыми кислотами +
в) основными оксидами
г) амфотерными гидроксидами +
43. Щелочь может образовываться при взаимодействии?
а) калия и воды +
б) карбоната натрия и гидроксида бария (водные растворы) +
в) хлорида алюминия и гидроксида аммония (водные растворы)
г) оксида натрия и воды +
44. Щелочи могут реагировать:
а) только с сильными кислотами
б) как с сильными, так и со слабыми кислотами +
в) только с кислотными оксидами
г) как с кислотными, так и с амфотерными оксидами +
45. Основание не образуется при взаимодействии избытка разбавленного раствора щелочи с:
а) сульфатом алюминия +
б) хлоридом железа (II)
в) нитратом аммония
г) хлоридом цинка +
46. При нагревании сравнительно легко разлагаются:
а) гидроксид калия
б) гидроксид меди (II) +
в) гидроксидом натрия
г) гидроксидом алюминия +
47. Охарактеризуйте свойства оксида кремния (IV):
а) амфотерный
б) кислотный +
в) не реагирует с водой +
г) вытесняет при нагревании из кристаллических карбонатов оксид углерода (IV)
48. Оксид фосфора (V) не реагируют с:
а) водой
б) щелочами
в) основными оксидами
г) кислотами +
49. С какими веществами, формулы которых приведены ниже, реагирует
а) оксид бария +
б) вода
в) серная кислота
г) гидроксид натрия +
50. Наиболее выраженными кислотными свойствами обладает:
а) оксид висмута (V)
б) оксид фосфора (V)
в) оксид азота (V) +
г) оксид мышьяка (V) [27-30].
Обсуждение результатов. Выводы
В эксперименте принимали участие ученики 8 классов МОУ СОШ-гимназии № 5 (выборочная совокупность составляла 45 школьников).В экспериментальных классах были проведены разработанные уроки - экскурсии, приведенные в главе 3. Занятия проводились с акцентом на прикладные и экологические аспекты.
Для констатации результата после проведения разработанных занятий были проведены контрольные работы, состоящие из тестов, которые приведены в главе III. Результаты эксперимента в школе приведены на диаграмме, отражающей изменения качества знаний и успеваемости в контрольном (8 а) и экспериментальном (8 в) классах.

Диаграмма 1. Изменение успеваемости учащихся
Таким образом, избранная тематика способствовала повышению качества знаний, научного и экологического мировоззрения, а главное вызвала интерес учащихся к более глубокому изучению химии.
На основе проведенной работы можно сделать следующие выводы:
1. Доказано, что использование на уроках химии экскурсий с акцентом на экологические знания развивает умения наблюдать факты и явления и объяснять их сущность в свете изученных теорий и законов; формирует и совершенствует экспериментальные умения и навыки.
2. Оценен уровень сформированности знаний и познавательной активности при изучении заданной темы по разработанным методическим подходам.
Изучив проблему использования экскурсий для формирования экологического мировоззрения школьников, мы можем утверждать, что гипотеза "Систематическое использование экскурсий на уроках химии способствует развитию мыслительной деятельности, познавательного интереса учащихся, более прочному и глубокому усвоению материала и формированию экологического мировоззрения и профориентации", подтверждена в ходе эксперимента.
Литература
1. Чернобельская Г.М. Методика обучения химии в средней школе. М.: ВЛАДОС, 2000. с.12-63.2. Оржековский П.А. Формирование у учащихся опыта творческой деятельности при обучении химии. - М.: 1997. С.121.
3. Теоретические основы содержания общего среднего образования / Под ред.В. В. Краевского, И.Я. Лернера. - М.: 1983. С.211.
4. Сафонова М.В. Экскурсии на химические производства. - М.: 1998.
5. Бабанский Ю.К. Об актуальных проблемах совершенствования обучения в общеобразовательной школе // Советская педагогика, 1979, № 3. С.3-10.
6. Чернобельская Г.М., Трухина М.Д., Шелехова Л.М. Пропедевтический курс химии с прикладным содержанием для VIIIкласса // Химия в школе, 1995, № 4.С. 19.
7. Назаренко В.М. Химия, экология, нравственность: проблемы образования // Химия в школе, 1995, № 3. С. 2.
8. Макареня А.А., Обухов В.Л. Методология химии. - М.: Просвещение, 1985.
9. Бабанский Ю.К. Оптимизация процесса обучения. - М.: Педагогика, 1977.
10. Вивюрский В.Я. Заключительные уроки по химии в средней школе. - М.: Просвещение, 1980.
11. Производственные экскурсии по химии: Сб. статей из опыта учителей/ Под ред. Л.А. Цветкова. - М. Учпедгиз, 1953. - с.135.
12. Митлена Э.М. Создание эмоционального настроя учащихся на уроках. Химия в школе, 1989, № 6.
13. Яншин А.Л., Мелуа А.И. Уроки экологических просчетов. М.: Мысль - 1991.
14. Шиленков Р.В., Чернобельская Г.М. Развитие самостоятельности учащихся в условиях индивидуализации обучения // Химия в школе. - 2004. - №5. - с.18-19.
15. Соколова О.Е. Технология педагогических мастерских: развитие творческих способностей учащихся // Химия в школе. - 2001. - №7. - с.14-15.
16. Зайцев О.С. Методика обучения химии: Теоретический и прикладной аспекты. - М.: Гуманит. изд. ВЛАДОС, 1999. - 358 с.
17. Обучение химии в 11 классе. В 2 ч. Ч 1: Кн. Для учителя / Под ред. И.Н. Черткова. - М.: просвещение, 1992. - с.6 - 20.
18. Боброва О.В. Организация самостоятельной работы учащихся при изучении нового материала // Химия в школе. - 1996. - №5. - с.23.
19. Эпштейн Д.А. Общая химическая технология. - М.: Химия, 1979. - с.312.
20. Монахова В.М., Орлова В.А. Теория и практика проведения факультативных занятий. - М.: Просвещение, 1983. - С.150.
21. Дьякович С.В. Методика факультативных занятий по химии. - М.: Просвещение, 1985. - С.175.
22. Пидкасистый П.И. Самостоятельная деятельность учащихся. - М.: Педагогика, 1972. - С. 200.
23. Скаткина М.Н. Дидактика средней школы. - М.: Просвещение, 1982. - С.180.
24. Егорова H.В. Наш подход к экологическому образованию учащихся // Химия в школе. - 2002. - № 5. - С.40 - 43.
25. Табуева Э.М. Экологическое образование как фактор формирования культурного потенциала личности // Химия в школе. - 2004. - №5. - С.18-19.
26. Шиленков Р.В., Чернобельская Г.М. Развитие самостоятельности учащихся в условиях индивидуализации обучения // Химия в школе. - 2004. - №5. - С.18-19.
27. Кирюшкин Д.М., В.С. Полосин. Методика обучения химии. - М.: Просвещение, 1970. - C.297 - 302.
28. Эпштейн Д.А. Факультативные занятия по химии. - М.: Просвещение, 1971. - С.175.
29. Афонина И.Г. Тестовые задания в курсе химии. // Химия в школе. - 2002. - № 7. - С.43 - 45.
30. Химия: Сборник тестовых заданий для подготовки к итоговой аттестации (варианты и ответы, решение расчетных задач).9 класс (базовый уровень) / Н.В. Ширшина. - Волгоград.: Учитель, 2004. - С.81.