Курсовая на тему Профилактика наследственной и врожденной патологии Пренатальная диагностика
Работа добавлена на сайт bukvasha.net: 2013-10-19Поможем написать учебную работу
Если у вас возникли сложности с курсовой, контрольной, дипломной, рефератом, отчетом по практике, научно-исследовательской и любой другой работой - мы готовы помочь.

Предоплата всего
от 25%

Подписываем
договор
I. Механизмы развития наследственных болезней
Наследственные болезни возникают вследствие изменения наследственного аппарата клетки (мутаций), которые вызываются лучевой, тепловой энергией, химическими веществами и биологическими факторами. Ряд мутаций вызывается генетическими рекомбинациями, несовершенством процессов репарации, возникает в результате ошибок биосинтеза белков и нуклеиновых кислот.
Мутации затрагивают как соматические, так и половые клетки. Различают геномные, генные мутации и хромосомные аберрации. Поскольку патогенез наследственных заболеваний во многом определяется характером мутационного изменения, стоит рассмотреть мутации более подробно.
Геномные мутации – это изменение плоидности, обычно увеличение: триплоидия, тетраплоидия. У человека полиплоидия обычно с жизнью несовместима.
Хромосомные аберрации – это изменение структуры хромосом: делеция (отрыв части хромосомы), инверсия (поворот чачти хромосомы на 1800), транслокации (перемещение части одной хромосомы на другую) и др. Изучение хромосомных аберраций стало более доступно после разработки метода дифференциальной окраски хромосом. Хромосомные аберрации, как правило, приводят к менее тяжелым дефектам организма по сравнению с моносомией или трисомией по целой хромосоме.
Генные мутации вызываются изменением структуры ДНК. Это приводит к нарушению синтеза полипептидных цепей белковых молекул, структурных, транспортных белков или белков-ферментов. Почти половина наследственных заболеваний – это следствие генных мутаций.
Мутации бывают спонтанные и индуцированные. Спонтанные мутации возникают примерно с частотой 10-15 и 10-10 на ген в течение 30 лет. Спонтанные мутации имеют большое значение для эволюции, многие из них подхватываются отбором. Индуцированные мутации вызываются лучевой, тепловой и механической энергией, а также химическими веществами, в том числе и медикаментозными средствами, и некоторыми биологическими факторами.
При мутациях возникают разнообразные изменения молекулы ДНК:
1.Замена одного аналогичного азотистого основания другим (транзиции);
2. Изменение числа нуклеотидов;
3. Инверсии – повором участка ДНК на 1800;
4. Транслокация – перенос одного участка ДНК на другой;
5. Транспозиция – внедрение в геном разнообразных «прыгающих» генов или вирусов и вирусоподобных элементов.
6. Химическая модификация азотистого основания, одно- или двунитчатый разрыв ДНК, образование их поперечных сшивок.
В клетке имеется несколько защитных систем, препятствующих развитию первичного повреждения ДНК и реализации его в мутацию. Прежде всего это система антиоксидантной защиты, которая снижает концентрацию свободных радикалов в клетке. Сюда входят раздичные ферменты, эндогенные и экзогенные антиоксиданты и антерадикальные соединения и т.п. Эта система антиоксидантной защиты предохраняет генетически важные молекулы от повреждения свободными радикалами и другими химически активными соединениями. После того как первичное повреждение ДНК осуществилос, включаются сложные процессы репарации – фотореактиыация, эксцизионная, пострепликационная, SOS-репарация и другие, еще малоизученные или совсем неизвестные механизмы восстановления клетки и генетической нуклеиновой кислоты. Если повреждение не устранено, в действие вступает система промивоинформационной защиты, задача которой – нейтрализовать дейсвие измененной информации. В случае прорыва одного барьера не пути реализации первичного повреждения в мутацию задействуются другие механизмы антимутационных барьеров. Назовем некоторые из них. Во-первых, это все механизмы, обеспечивающие надежность биологических систем: дублированность клеточных структур, наличие обходных метаболических путей, особая организация генетического кода и аппарата синтеза белков. Во-вторых, если произошла замена аминокислоты в полипептидной цепи балка, то при этом имеет значение сохранение гидрофильного или гидрофобного характера новой аминокислоты, влияющего на сохранение третичной – глобулярной – структуры белковой молекулы. Примерно при 1/3 всех аминокислотных замен сохраняются пространственная структура глобулярных белков и их биологическая функция – потенциально мутационное первичное повреждение ДНЕ гасится, нейтрализуется.
Антимутационные барьеры клетки и организма многочисленны и разнообразны, они еще не до конца изучены. Они позволяют человеку жить во враждебном мире мутагенных факторов.
Генные мутации обычно не сопровождаются изменением формы хромосом, поэтому в световом микроскопе их заметить невозможно.
Они проявляются в изменении признаков организма вследствие синтеза измененных белков ферментов или структурных или регуляторных белков. В результате мутации активность фермента может изменяться – повышаться или понижаться. Степень изменения активности фермента зависит от места мутации в соответствующем гене и величине дефекта. Поэтому в улинической картине выраженность наследственных заболеваний всегда разная, хотя дефектный ген один и тот же. Кроме того, наблюдается разная выраженность нормального и измененного аллеля пределенного гена. У человека набор зромосом и соотвественно генов диплоидный. Мутации обычно затрагивают один из двух аллелей одного и того же гена. В результате возникает гетерозиготность. Фенотип таких гетерозигот определяется взаимодействием соответствующих аллелей и генетического или эпигенетического поля, создаваемого всеми другими генами во взаимодействии со средой. Молекулярные механизмы некоторых наследственных заболеваний, вызываемых генной мутацией, более или менее уже изучены. Такие наследственные заболевания получили название молекулярных.
II. Принципы лечения наследственных болезней
Долгое время наследственные болезни считались неизлечимыми, однако благодаря достижениям генетики, молекулярной биологии, биохимии, цитологии и биофизики раскрыты патогенетические механизмы ряда наследственных заболеваний, относящихся к группе молекулярных. Поэтому в настоящее время открывается возможность патогенетической терапии ряда из них. Все моногенные заболевания обусловлены нарушением генной экспрессии на уровне ДНК. Эти нарушения вызваны как повреждением отдельных структурных или регуляторных генов, так и целых участков ДНК. Повреждения ДНК могут иметь различную природу, а именно: точечные мутации, делеции, транслокации, инверсии и т.д. Такие дефекты могут привести к модификации, редукции или к полному нарушению структуры белка, кодируемого поврежденным геном, и исчезновению его функций. В гомозиготных рецессивных или гетерозиготных доминантных случаях это может привести к развитию клинических симптомов наследственных заболеваний, многие из которых моногенны. Их частота 1:100 000.
Симптоматическая терапия наследственных болезней.
В большинстве случаев, наследственной патологии, где пока невозможна патогенетическая терапия (исправление структуры патологических молекул), состояние больных может облегчить симптоматическая терапия.
В последние годы разрабатываются перспективные методы лечения и диагностики наследственных заболевания – биологическая инженерия и биотехнология, задачей которых является создание новых генетических структур на разных уровнях: генном, геномном, клеточном, тканевом, органном и популяционном.
Генная инженерия – это введение в клетку нормального гена и последующее получение клона клеток с измененными наследственными свойствами.
Хромосомная инженерия – конструирование хроматина (сборка нуклеосом из ДНК и гистонов, более сложных структур) и целых хромосом. Уже синтезирована, например, хромосома дрожжей со всеми регуляторными структурами.
Геномная инженерия – это создание нового генома в клетке.
Эмбриональными инженерами за последнее время были достигнуты значительные успехи в области искусственного оплодотворения в пробирке и методики имплантации эмбриона. Сейчас уже всем известны «дети из пробирки», которые нормально растут и развиваются. Метод позволяет решить проблему стерильности супругов.
Бурный расцвет переживает иммунная инженерия. Получены гибридные клетки путем слияния клетки миеломы, способной к беспредельному размножению, с лимфоцитом иммунизированного животного, который вырабатывает антитела против определенного антигена.
Синтез и введение в организм искусственных генов представляет колоссальны возможности для исправления несправедливой природы: можно будет навсегда избавиться от половины врожденных пороков развития сердца, костно-мышечной системы, человек сможет планомерно управлять эволюцией биологических видов, многократно ускоряя и упрочивая этот пока стихийный процесс.
Наряду с положительными сторонами генной инженерии, нельзя забывать и об отрицательных последствиях ее применения. Новые микроорганизмы могут приобрести необычную патогенность или резистентность к известным лекарственным веществам. Последствия прорыва защитных лабораторных барьеров патогенным рекомбинантным микроорганизмам трудно себе представить. Кроме того, процессы образования рекомбинатных молекул могут сопровождаться резким увеличением интенсивности мутагенеза у человека, особенно пре введении в клетку экзогенных нуклеиновых кислот. Это может привести к повреждению генетического кода человечества. Особенно большая опасность заключается в том, что составной частью рекомбинатных молекул может быть ДНК Е. Соli – обычного представителя кишечной флоры человека, могущего стать патогенным при изменении своего генома. Здесь, как видим, кроются возможности таких ужасов, перед которыми бледнеют пророчества Апокалипсиса. Такие бактерии-рекомбинанты могут служить источником разного рода эпидемий.
III. Профилактика и проблемы профилактики наследственных болезней
Сейчас главная задача – сохранить наши гены от повреждений, вызываемых многочисленными загрязнениями внешней среды, стрессами, гиподинамией и другими факторами. Мы должны передать следующим поколениям свои гены в целости и сохранности, передать все их разнообразие, ибо разнообразие генов – наше главное богатство.
Вмешательство в генетический аппарат клеток наго организма может привести к необратимому их повреждению. Нужно сохранить, а не переливать наш генофонд половых и соматических клеток.
Профилактика наследственных болезней должна быть направлена на максимальное устранение влияний на организм разнообразных мутагенных факторов: лучевой, тепловой энергии, химических веществ, в том числе и медикаментозных средств, биологических мутагенов.
Особенно надо оберегать от этих воздействий молодых людей детородного возраста. Молодым людям не должны проводиться гемотрансфузии без острых на то показаний. Спиртные напитки и курение до беременности и во время беременности пагубно влияют на потомство, а также гиподинамия, стрессы.
Алкоголь и продукты его дальнейшего обмена оказывают токсическое влияние на все ткани, особенно богатые водой, как-то мозг и печень. Они оказывают влияние и на половые железы и половые клетки. В половых клетках они могут повреждать генетический аппарат – ромосомы, нуклеиновые кислоты. Значительные повреждения приводят к уменьшению зачатия и снижению рождаемости. Менее значительные повреждения приводят к развитию эмбрионов и детей с различными уродствами.
Особенно большой вред потомству приносит употребление этанола женщиной во время беременности. Также огромным тератогенным влиянием обладают наркотики и транквилизаторы.
Важной является пропаганда генетических знаний среди населения. Больным некоторыми наследственными заболеваниями следует воздержаться от деторождения. Недопустимы близкородственные браки между лицами, в семьях которых наблюдаются наследственные заболевания. Важным является выявление гетерозиготных носителей патологического гена и предупреждение о нежелательности браков между такими носителями. Они должны вступать в брак со здоровыми по данным генам лицами. Опасение, что браки между носителями патологических генов и здоровыми людьми могут вызвать «засорение популяции», многие ученые считают необоснованным, так как в этих браках понижена рождаемость, а также потому, что гетерозиготные носители патологических генов затрагивают минимальную часть населения.
Генетика человека большинством своих достижений обязана тому, что она опиралась на законы Менделя и использовала методы, разработанные в различных областях биологии. Такие важные проблемы, как регуляция активности генов, особенно во время эмбрионального развития, регуляция деятельности иммунной системы и работы мозга выходят за рамки имеющихся фундаментальных представлений, однако эти рамки постоянно расширяются. Генетика человека вносит вклад в решение этих проблем путем исследования генетического разнообразия и заболеваний с помощью новейших методов; чтобы понять причины наследственных болезней, необходимо разобраться в механизмах действия гена во время эмбрионального развития, выявить специфические гены, ответственные за возникновение различных заболеваний.
На первый взгляд история генетики человека за предыдущие тридцать лет выглядит как непрерывная цепь успехов. Но как оценят наши потомки попытки поставить генетику человека на службу человечеству таким образом, как мы это понимаем? Будут ли они видеть этические различия между избирательным прерыванием беременности в случае эмбриона с синдромом Дауна и уничтожением новорожденных с грубыми пороками развития? Не скатываемся ли мы опять вниз по «наклонной плоскости?»
IV. Клиническая генетика и роль медико-генетических консультаций
Клиническая генетика бурно развивается. Организуются специальные клиники, где осуществляется диагностика наследственных заболеваний и можно получить генетическую консультацию. Выявляется значительная гетерогенность наследственных болезней. Основная задача генетических консультаций сейчас состоит в том, чтобы обеспечить пациентов и их семьи сведениями о риске рождения ребенка с такой же аномалией и о контроле деторождения. Во многих странах осуществляются программы по проверке всех новорожденных на наличие фенилкетонурии, а другие программы скрининга проходят всестороннюю проверку.
Методы исследования ДНК в медицинской генетике. Достижения молекулярной генетики и развитие методов исследования ДНК быстро нашли применение для решения практических задач медицинской генетики. Поскольку наиболее существенные успехи в изучении генетических систем достигнуты в случае глобиновых генов, полученные данные нашли непосредственное применение для диагностики гомеопатий. При этом было использовано несколько подходов. Было обнаружено, что наличие фенотипически не проявляющихся наследуемых различий в последовательности оснований ДНК носит общий характер. Это предполагает существование значительного полиморфизма ДНК, который можно изучать. Точно так же как каждое человеческое лицо уникально, каждый человек имеет уникальную последовательность оснований ДНК. Отличительные особенности последовательностей оснований ДНК используется в генеалогических исследованиях как генетические маркеры, позволяющие установить наличие тесно сцепленных с ними генов, вызывающих моногенные заболевания. Прямая диагностика генетических заболеваний осуществляется благодаря использованию коротких последовательностей нуклеотидов, гомологичных мутировавшим участкам, которые нужно найти. Разные мутации одного и того же локуса обычно приводят к возникновению фенотипически идентичных заболеваний. Это затрудняет прямую диагностику путем исследования ДНК без генеалогического анализа, за исключением тех случаев, когда известна специфическая мутация, называемая заболевание.
Исследуются и возможности использования ДНК для лечения наследственных заболеваний. В настоящее время усилия в этой области направлены на встраивание ДНК нормальных генов в соматические клетки, такие, как клетки костного мозга.
Роль медико-генетических консультаций в профилактике наследственных заболеваний проявляется в следующем. Появление в семье ребенка с наследственным заболеванием является большим несчастьем и порождает ряд вопросов как у самих родителей, так и у их родственников. Это прежде всего вопросы о дальнейшем деторождении, о судьбе братьев и сестер и т.д. На ряд этих вопросов ответить невозможно без сложных современных цитологических исследований. Врач, которому будут заданы эти вопросы, должен быть хорошо подготовленным в вопросах общей и клинической генетики, особенно хорошо распознавать наследственные заболевания. Если подозревается наличие моногенного молекулярного заболевания, то прежде всего необходимо установить, наследственно ли данное заболевание или речь идет только об его фенокопии. Затем необходимо выяснить тип наследования, знать пенетрантность данного патологического гена и критический возраст, в котором он обычно проявляется. Следует также определить, какой характер носит изучаемое наследственное заболевание: получено ли оно по наследству от больных родителей ли же возникла новая мутация в гаметах здоровых родителей или в клетках зиготы на первых этапах дробления. Только после уяснения всех этих вопросов можно дать определенное заключение и те или иные советы. Нередко один врач-генетик эти вопросы самостоятельно решить не может, особенно установить характер заболевания, в частности определить, наследственное ли данное заболевание . Врач-генетик должен работать в содружестве с высококвалифицированными специалистами в области разных клинических дисциплин. Из этих соображений медико-генетическую консультацию целесообразно организовывать при крупных многопрофильных поликлинических отделениях. Консультация должна располагать современной цитологической и биохимической лабораториями, так как окончательный диагноз обычно подтверждается биохимическими или цитологическими исследованиями.
Врач-генетик должен лично осмотреть больного и его родителей, а также ближайших родственников, что очень важно для установления типа наследования, так как заболевание нередко проявляется микросимптомами, из-за чего наблюдаются случаи «пропуска» заболевания в поколениях, вследствие чего неправильно делается заключение о новой мутации. Особенно надо быть осторожным с заключением о возникновении новой мутации при аутосомно-рецессивных заболеваниях. Известно, что аутосомно-рецессивное заболевание возникает у гомозигот при встрече в супружеской паре других гетерозигот по данному гену. Возникновение одной и той же новой мутации в гомологичных локусах хромосом обоих супругов мало вероятно, поэтому необходимо тщательное клиническое и биохимическое исследование обоих супругов. Наследственные болезни возникают вследствие изменения наследственного аппарата клетки (мутаций), которые вызываются лучевой, тепловой энергией, химическими веществами и биологическими факторами. Ряд мутаций вызывается генетическими рекомбинациями, несовершенством процессов репарации, возникает в результате ошибок биосинтеза белков и нуклеиновых кислот.
Мутации затрагивают как соматические, так и половые клетки. Различают геномные, генные мутации и хромосомные аберрации. Поскольку патогенез наследственных заболеваний во многом определяется характером мутационного изменения, стоит рассмотреть мутации более подробно.
Геномные мутации – это изменение плоидности, обычно увеличение: триплоидия, тетраплоидия. У человека полиплоидия обычно с жизнью несовместима.
Хромосомные аберрации – это изменение структуры хромосом: делеция (отрыв части хромосомы), инверсия (поворот чачти хромосомы на 1800), транслокации (перемещение части одной хромосомы на другую) и др. Изучение хромосомных аберраций стало более доступно после разработки метода дифференциальной окраски хромосом. Хромосомные аберрации, как правило, приводят к менее тяжелым дефектам организма по сравнению с моносомией или трисомией по целой хромосоме.
Генные мутации вызываются изменением структуры ДНК. Это приводит к нарушению синтеза полипептидных цепей белковых молекул, структурных, транспортных белков или белков-ферментов. Почти половина наследственных заболеваний – это следствие генных мутаций.
Мутации бывают спонтанные и индуцированные. Спонтанные мутации возникают примерно с частотой 10-15 и 10-10 на ген в течение 30 лет. Спонтанные мутации имеют большое значение для эволюции, многие из них подхватываются отбором. Индуцированные мутации вызываются лучевой, тепловой и механической энергией, а также химическими веществами, в том числе и медикаментозными средствами, и некоторыми биологическими факторами.
При мутациях возникают разнообразные изменения молекулы ДНК:
1.Замена одного аналогичного азотистого основания другим (транзиции);
2. Изменение числа нуклеотидов;
3. Инверсии – повором участка ДНК на 1800;
4. Транслокация – перенос одного участка ДНК на другой;
5. Транспозиция – внедрение в геном разнообразных «прыгающих» генов или вирусов и вирусоподобных элементов.
6. Химическая модификация азотистого основания, одно- или двунитчатый разрыв ДНК, образование их поперечных сшивок.
В клетке имеется несколько защитных систем, препятствующих развитию первичного повреждения ДНК и реализации его в мутацию. Прежде всего это система антиоксидантной защиты, которая снижает концентрацию свободных радикалов в клетке. Сюда входят раздичные ферменты, эндогенные и экзогенные антиоксиданты и антерадикальные соединения и т.п. Эта система антиоксидантной защиты предохраняет генетически важные молекулы от повреждения свободными радикалами и другими химически активными соединениями. После того как первичное повреждение ДНК осуществилос, включаются сложные процессы репарации – фотореактиыация, эксцизионная, пострепликационная, SOS-репарация и другие, еще малоизученные или совсем неизвестные механизмы восстановления клетки и генетической нуклеиновой кислоты. Если повреждение не устранено, в действие вступает система промивоинформационной защиты, задача которой – нейтрализовать дейсвие измененной информации. В случае прорыва одного барьера не пути реализации первичного повреждения в мутацию задействуются другие механизмы антимутационных барьеров. Назовем некоторые из них. Во-первых, это все механизмы, обеспечивающие надежность биологических систем: дублированность клеточных структур, наличие обходных метаболических путей, особая организация генетического кода и аппарата синтеза белков. Во-вторых, если произошла замена аминокислоты в полипептидной цепи балка, то при этом имеет значение сохранение гидрофильного или гидрофобного характера новой аминокислоты, влияющего на сохранение третичной – глобулярной – структуры белковой молекулы. Примерно при 1/3 всех аминокислотных замен сохраняются пространственная структура глобулярных белков и их биологическая функция – потенциально мутационное первичное повреждение ДНЕ гасится, нейтрализуется.
Антимутационные барьеры клетки и организма многочисленны и разнообразны, они еще не до конца изучены. Они позволяют человеку жить во враждебном мире мутагенных факторов.
Генные мутации обычно не сопровождаются изменением формы хромосом, поэтому в световом микроскопе их заметить невозможно.
Они проявляются в изменении признаков организма вследствие синтеза измененных белков ферментов или структурных или регуляторных белков. В результате мутации активность фермента может изменяться – повышаться или понижаться. Степень изменения активности фермента зависит от места мутации в соответствующем гене и величине дефекта. Поэтому в улинической картине выраженность наследственных заболеваний всегда разная, хотя дефектный ген один и тот же. Кроме того, наблюдается разная выраженность нормального и измененного аллеля пределенного гена. У человека набор зромосом и соотвественно генов диплоидный. Мутации обычно затрагивают один из двух аллелей одного и того же гена. В результате возникает гетерозиготность. Фенотип таких гетерозигот определяется взаимодействием соответствующих аллелей и генетического или эпигенетического поля, создаваемого всеми другими генами во взаимодействии со средой. Молекулярные механизмы некоторых наследственных заболеваний, вызываемых генной мутацией, более или менее уже изучены. Такие наследственные заболевания получили название молекулярных.
II. Принципы лечения наследственных болезней
Долгое время наследственные болезни считались неизлечимыми, однако благодаря достижениям генетики, молекулярной биологии, биохимии, цитологии и биофизики раскрыты патогенетические механизмы ряда наследственных заболеваний, относящихся к группе молекулярных. Поэтому в настоящее время открывается возможность патогенетической терапии ряда из них. Все моногенные заболевания обусловлены нарушением генной экспрессии на уровне ДНК. Эти нарушения вызваны как повреждением отдельных структурных или регуляторных генов, так и целых участков ДНК. Повреждения ДНК могут иметь различную природу, а именно: точечные мутации, делеции, транслокации, инверсии и т.д. Такие дефекты могут привести к модификации, редукции или к полному нарушению структуры белка, кодируемого поврежденным геном, и исчезновению его функций. В гомозиготных рецессивных или гетерозиготных доминантных случаях это может привести к развитию клинических симптомов наследственных заболеваний, многие из которых моногенны. Их частота 1:100 000.
Симптоматическая терапия наследственных болезней.
В большинстве случаев, наследственной патологии, где пока невозможна патогенетическая терапия (исправление структуры патологических молекул), состояние больных может облегчить симптоматическая терапия.
В последние годы разрабатываются перспективные методы лечения и диагностики наследственных заболевания – биологическая инженерия и биотехнология, задачей которых является создание новых генетических структур на разных уровнях: генном, геномном, клеточном, тканевом, органном и популяционном.
Генная инженерия – это введение в клетку нормального гена и последующее получение клона клеток с измененными наследственными свойствами.
Хромосомная инженерия – конструирование хроматина (сборка нуклеосом из ДНК и гистонов, более сложных структур) и целых хромосом. Уже синтезирована, например, хромосома дрожжей со всеми регуляторными структурами.
Геномная инженерия – это создание нового генома в клетке.
Эмбриональными инженерами за последнее время были достигнуты значительные успехи в области искусственного оплодотворения в пробирке и методики имплантации эмбриона. Сейчас уже всем известны «дети из пробирки», которые нормально растут и развиваются. Метод позволяет решить проблему стерильности супругов.
Бурный расцвет переживает иммунная инженерия. Получены гибридные клетки путем слияния клетки миеломы, способной к беспредельному размножению, с лимфоцитом иммунизированного животного, который вырабатывает антитела против определенного антигена.
Синтез и введение в организм искусственных генов представляет колоссальны возможности для исправления несправедливой природы: можно будет навсегда избавиться от половины врожденных пороков развития сердца, костно-мышечной системы, человек сможет планомерно управлять эволюцией биологических видов, многократно ускоряя и упрочивая этот пока стихийный процесс.
Наряду с положительными сторонами генной инженерии, нельзя забывать и об отрицательных последствиях ее применения. Новые микроорганизмы могут приобрести необычную патогенность или резистентность к известным лекарственным веществам. Последствия прорыва защитных лабораторных барьеров патогенным рекомбинантным микроорганизмам трудно себе представить. Кроме того, процессы образования рекомбинатных молекул могут сопровождаться резким увеличением интенсивности мутагенеза у человека, особенно пре введении в клетку экзогенных нуклеиновых кислот. Это может привести к повреждению генетического кода человечества. Особенно большая опасность заключается в том, что составной частью рекомбинатных молекул может быть ДНК Е. Соli – обычного представителя кишечной флоры человека, могущего стать патогенным при изменении своего генома. Здесь, как видим, кроются возможности таких ужасов, перед которыми бледнеют пророчества Апокалипсиса. Такие бактерии-рекомбинанты могут служить источником разного рода эпидемий.
III. Профилактика и проблемы профилактики наследственных болезней
Сейчас главная задача – сохранить наши гены от повреждений, вызываемых многочисленными загрязнениями внешней среды, стрессами, гиподинамией и другими факторами. Мы должны передать следующим поколениям свои гены в целости и сохранности, передать все их разнообразие, ибо разнообразие генов – наше главное богатство.
Вмешательство в генетический аппарат клеток наго организма может привести к необратимому их повреждению. Нужно сохранить, а не переливать наш генофонд половых и соматических клеток.
Профилактика наследственных болезней должна быть направлена на максимальное устранение влияний на организм разнообразных мутагенных факторов: лучевой, тепловой энергии, химических веществ, в том числе и медикаментозных средств, биологических мутагенов.
Особенно надо оберегать от этих воздействий молодых людей детородного возраста. Молодым людям не должны проводиться гемотрансфузии без острых на то показаний. Спиртные напитки и курение до беременности и во время беременности пагубно влияют на потомство, а также гиподинамия, стрессы.
Алкоголь и продукты его дальнейшего обмена оказывают токсическое влияние на все ткани, особенно богатые водой, как-то мозг и печень. Они оказывают влияние и на половые железы и половые клетки. В половых клетках они могут повреждать генетический аппарат – ромосомы, нуклеиновые кислоты. Значительные повреждения приводят к уменьшению зачатия и снижению рождаемости. Менее значительные повреждения приводят к развитию эмбрионов и детей с различными уродствами.
Особенно большой вред потомству приносит употребление этанола женщиной во время беременности. Также огромным тератогенным влиянием обладают наркотики и транквилизаторы.
Важной является пропаганда генетических знаний среди населения. Больным некоторыми наследственными заболеваниями следует воздержаться от деторождения. Недопустимы близкородственные браки между лицами, в семьях которых наблюдаются наследственные заболевания. Важным является выявление гетерозиготных носителей патологического гена и предупреждение о нежелательности браков между такими носителями. Они должны вступать в брак со здоровыми по данным генам лицами. Опасение, что браки между носителями патологических генов и здоровыми людьми могут вызвать «засорение популяции», многие ученые считают необоснованным, так как в этих браках понижена рождаемость, а также потому, что гетерозиготные носители патологических генов затрагивают минимальную часть населения.
Генетика человека большинством своих достижений обязана тому, что она опиралась на законы Менделя и использовала методы, разработанные в различных областях биологии. Такие важные проблемы, как регуляция активности генов, особенно во время эмбрионального развития, регуляция деятельности иммунной системы и работы мозга выходят за рамки имеющихся фундаментальных представлений, однако эти рамки постоянно расширяются. Генетика человека вносит вклад в решение этих проблем путем исследования генетического разнообразия и заболеваний с помощью новейших методов; чтобы понять причины наследственных болезней, необходимо разобраться в механизмах действия гена во время эмбрионального развития, выявить специфические гены, ответственные за возникновение различных заболеваний.
На первый взгляд история генетики человека за предыдущие тридцать лет выглядит как непрерывная цепь успехов. Но как оценят наши потомки попытки поставить генетику человека на службу человечеству таким образом, как мы это понимаем? Будут ли они видеть этические различия между избирательным прерыванием беременности в случае эмбриона с синдромом Дауна и уничтожением новорожденных с грубыми пороками развития? Не скатываемся ли мы опять вниз по «наклонной плоскости?»
IV. Клиническая генетика и роль медико-генетических консультаций
Клиническая генетика бурно развивается. Организуются специальные клиники, где осуществляется диагностика наследственных заболеваний и можно получить генетическую консультацию. Выявляется значительная гетерогенность наследственных болезней. Основная задача генетических консультаций сейчас состоит в том, чтобы обеспечить пациентов и их семьи сведениями о риске рождения ребенка с такой же аномалией и о контроле деторождения. Во многих странах осуществляются программы по проверке всех новорожденных на наличие фенилкетонурии, а другие программы скрининга проходят всестороннюю проверку.
Методы исследования ДНК в медицинской генетике. Достижения молекулярной генетики и развитие методов исследования ДНК быстро нашли применение для решения практических задач медицинской генетики. Поскольку наиболее существенные успехи в изучении генетических систем достигнуты в случае глобиновых генов, полученные данные нашли непосредственное применение для диагностики гомеопатий. При этом было использовано несколько подходов. Было обнаружено, что наличие фенотипически не проявляющихся наследуемых различий в последовательности оснований ДНК носит общий характер. Это предполагает существование значительного полиморфизма ДНК, который можно изучать. Точно так же как каждое человеческое лицо уникально, каждый человек имеет уникальную последовательность оснований ДНК. Отличительные особенности последовательностей оснований ДНК используется в генеалогических исследованиях как генетические маркеры, позволяющие установить наличие тесно сцепленных с ними генов, вызывающих моногенные заболевания. Прямая диагностика генетических заболеваний осуществляется благодаря использованию коротких последовательностей нуклеотидов, гомологичных мутировавшим участкам, которые нужно найти. Разные мутации одного и того же локуса обычно приводят к возникновению фенотипически идентичных заболеваний. Это затрудняет прямую диагностику путем исследования ДНК без генеалогического анализа, за исключением тех случаев, когда известна специфическая мутация, называемая заболевание.
Исследуются и возможности использования ДНК для лечения наследственных заболеваний. В настоящее время усилия в этой области направлены на встраивание ДНК нормальных генов в соматические клетки, такие, как клетки костного мозга.
Роль медико-генетических консультаций в профилактике наследственных заболеваний проявляется в следующем. Появление в семье ребенка с наследственным заболеванием является большим несчастьем и порождает ряд вопросов как у самих родителей, так и у их родственников. Это прежде всего вопросы о дальнейшем деторождении, о судьбе братьев и сестер и т.д. На ряд этих вопросов ответить невозможно без сложных современных цитологических исследований. Врач, которому будут заданы эти вопросы, должен быть хорошо подготовленным в вопросах общей и клинической генетики, особенно хорошо распознавать наследственные заболевания. Если подозревается наличие моногенного молекулярного заболевания, то прежде всего необходимо установить, наследственно ли данное заболевание или речь идет только об его фенокопии. Затем необходимо выяснить тип наследования, знать пенетрантность данного патологического гена и критический возраст, в котором он обычно проявляется. Следует также определить, какой характер носит изучаемое наследственное заболевание: получено ли оно по наследству от больных родителей ли же возникла новая мутация в гаметах здоровых родителей или в клетках зиготы на первых этапах дробления. Только после уяснения всех этих вопросов можно дать определенное заключение и те или иные советы. Нередко один врач-генетик эти вопросы самостоятельно решить не может, особенно установить характер заболевания, в частности определить, наследственное ли данное заболевание . Врач-генетик должен работать в содружестве с высококвалифицированными специалистами в области разных клинических дисциплин. Из этих соображений медико-генетическую консультацию целесообразно организовывать при крупных многопрофильных поликлинических отделениях. Консультация должна располагать современной цитологической и биохимической лабораториями, так как окончательный диагноз обычно подтверждается биохимическими или цитологическими исследованиями.
Прогноз потомства может быть различным в зависимости от того, как определяется наследование данного заболевания (моногенно или полигенно, или это хромосомное заболевание).
Нарушения структуры и функций генов, неизбежно приводящие каждого человека к старению, болезням и смерти, в результате экологической катастрофы могут вызывать вырождение и гибель всего человечества. Механизм родовой смерти человечества в природе не нужно изобретать – он уже существует и вызывает старение и смерть каждого человека. Только в случае индивидуальной смерти человека в основном повреждается генофонд соматических клеток, а вырождение и родовую смерть человека вызывает повреждение генов половых клеток. Однако генетика может показать нам путь к сохранению соматофонда и гаметофонда. Перед человеком открываются новые перспективы бессмертия – как личного, так и родового. В последние годы сформировался научный иммортализм – учение о путях достижения бессмертия. Сейчас же ученые отвечают: и жизнь познаваема, и смерть победима. Современная наука, вооруженная мощными молекулярно-биологическими и генетическими методами исследования, успешно работает над проблемой преодоления болезней, старения и даже самой смерти.
V. Пренатальная диагностика
Плод в утробе матери находится в амниотическом мешке и омывается амниотической жидкостью. Между плодом и жидкостью постоянно происходит обмен веществ. Установлено, что доношенный плод ежесуточно заглатывает около 450 см3 жидкости и выделяет 500 см3 мочи. Поэтому в амниотической жидкости постоянно находятся продукты обмена плода и слущивающиеся клетки его кожи и слизистых оболочек. Исследуя состояние клеточных элементов и продуктов обмена эмбриона в амниотической жидкости, можно в известной степени, судить о состоянии плода, о его кариотипе и многих нарушениях обмена веществ.
В крупных медико-генетических центрах как за рубежом, так и в нашей стране с целью ранней диагностики наследственных дефектов проводится исследование продуктов обмена веществ плода, находящихся в амниотической жидкости. Оптимальным временем проведения этих исследований является 15-16 недель беременности. В это время объем амниотической жидкости равен около 200 см3. Для проведения исследования достаточно всего 10-20 см3. Амниоцентез проводится в условиях абсолютной стерильности. Применяются трансвагинальный и трансабдоминальный способы амниоцентеза. Последний получил большое признание.
Прнатальная (дородовая) диагностика
Пренатальная (иначе говоря — дородовая) диагностика — одно из самых молодых и бурно развивающихся направлений современной репродуктивной медицины. Представляя собой процесс обнаружения или исключения различных заболеваний у находящегося в матке плода, пренатальная диагностика и базирующееся на ее результатах медико-генетическое консультирование отвечают на жизненно важные для каждого будущего родителя вопросы. Болен плод или нет? Как может повлиять обнаруженная болезнь на качество жизни будущего ребенка? Возможно ли эффективное лечение болезни после рождения малыша? Эти ответы позволяют семье осознанно и своевременно решить вопрос о дальнейшей судьбе беременности — и тем самым смягчить психическую травму, вызываемую рождением малыша с неизлечимой инвалидизирующей патологией.
Современная пренатальная диагностика использует самые различные технологии. Все они обладают разными возможностями и степенью надежности. Некоторые из этих технологий — ультразвуковой скрининг (динамическое наблюдение) развития плода и скрининг сывороточных факторов материнской крови считаются неинвазивными или малоинвазивными — т.е. не предусматривают хирургического вторжения в полость матки. Практически безопасные для плода, эти диагностические процедуры рекомендуются всем без исключения будущим мамам. Другие же технологии (биопсия хориона или амниоцентез, например) являются инвазивными — т.е. предполагают хирургическое вторжение в полость матки с целью взятия плодного материала для последующего лабораторного исследования. Понятно, что инвазивные процедуры небезопасны для плода и потому практикуются только в особых случаях. В рамках одной статьи невозможно детально разобрать все ситуации, в которых семье могут понадобиться инвазивные диагностические процедуры, — слишком уж разнообразны проявления наследственных и врожденных заболеваний, известных современной медицине. Однако общую рекомендацию всем планирующим рождение ребенка семьям дать все же можно: обязательно посетите медико-генетическую консультацию (желательно — еще до наступления беременности) и ни в коем случае не игнорируйте ультразвуковой и сывороточный скрининг. Это позволит своевременно решить вопрос о необходимости (и оправданности) инвазивного исследования. С основными характеристиками различных методов пренатальной диагностики можно познакомиться в приведенных ниже таблицах.
Подавляющее большинство из перечисленных ниже методов пренатальной диагностики врожденных и наследственных заболеваний сегодня достаточно широко практикуется в России. УЗ-скрининг беременных проводится в женских консультациях или учреждениях медико-генетической службы. Там же (в ряде городов) можно сделать и скрининг материнских сывороточных факторов (так называемый «тройной тест»). Инвазивные же процедуры проводятся преимущественно в крупных акушерских центрах или межрегиональных (областных) медико-генетических консультациях. Возможно, в самом ближайшем будущем все эти виды диагностической помощи в России будут сконцентрированы в специальных центрах пренатальной диагностики. По крайней мере, именно таким видит решение проблемы Минздрав РФ.
Что ж, как говорится, поживем — увидим. А пока всем планирующим пополнение семейства жителям городов и весей отечества не мешало бы заблаговременно поинтересоваться, какими возможностями в области пренатальной диагностики располагает местная медицина. И если эти возможности недостаточны, а потребность в качественной пренатальной диагностике объективно имеется, следует сразу же ориентироваться на обследование будущей мамы за пределами родного населенного пункта. Тем более, что часть финансовых затрат в данном случае вполне может взять на себя то самое местное здравоохранение, в арсенале которого отсутствует необходимый для семьи вид диагностической услуги.Развитие генетики соматических клеток привело к появлению в конце 60-х гг. пренатальной диагностики, основанной на амниоцентезе во второй трети беременности. Благодаря этой процедуре можно получить культуру эмбриональных амниотических клеток и с ее помощью осуществлять цитогенетические и биохимические исследования генотипа эмбриона, определять его пол и диагностировать различные внутриутробные нарушения. В начале 80-х гг. была разработана и широко используется биопсия ворсин хориона – исследование, которое можно проводить уже в первой трети беременность. Открытие того факта, что дефекты нервной трубки связаны с увеличением содеражания α-фетопротеина в амниотической жидкости, позволило осуществлять внутриматочную диагностику важной группы врожденных дефектов. Разработка метода фетоскопии сделала возможной пункцию сосудов плода для диагностики гемоглобинопатий и даже визуальное выявление некоторых пороков развития эмбриона. К арсеналу методов диагностики добавился ультразвуковой метод исследования плаценты и выявления аномалий плода. Этот метод быстро совершенствуется и все чаще позволяет проводить фенотипическое обследование плода. Поскольку ультразвуковой метод является методом наружного исследования, он все больше и больше вытесняет фетоскопию.
Этим термином обозначают медицинские мероприятия, с помощью которых можно установить наличие заболевания у еще не родившегося плода. Столь раннее установление диагноза неоценимо при наличии у плода тяжелых болезней, которые не поддаются лечению и поэтому приводят к инвалидности или смерти ребенка после рождения. Чаще всего пренатальная диагностика направлена на выявление у плода наследственных заболеваний и пороков развития. Существуют различные виды пренатальной диагностики. Инвазивные методы предполагают медицинское "вторжение" в полость матки. При этом забираются для исследований образцы околоплодных вод, хориона или плаценты, кровь из пуповины плода. К такого рода мероприятиям относятся биопсия хориона, амниоцентез, плацентоцентез и кордоцентез.
Существуют также и неинвазивные методы. При их проведении полость матки не затрагивается. Для исследования используют кровь беременной женщины (скрининг материнских сывороточных факторов), мазки из половых путей, а также проводят ультразвуковое сканирование плода, оболочек и плаценты. Более подробно суть этих исследований описана ниже.
Пренатальная диагностика отвечает на главный вопрос, поднимаемый при медико-генетическом консультировании: болен плод или нет?
В случае наличия у плода болезни родители тщательно взвешивают возможности современной медицины (с помощью врача-консультанта) и свои собственные в плане реабилитации ребенка. В итоге семья принимает решение о судьбе данной беременности: продолжать вынашивание или прервать? Еще раз подчеркну: решение принимает семья, а не кто-то посторонний. Задача врача - предоставить максимально полную информацию о данной болезни, возможностях ее лечения, прогнозе жизни и повторном риске (при последующих беременностях).
Показания к проведению пренатальной диагностики устанавливает врач, решение же о ее проведении принимает опять-таки консультируемая семья. Вопрос об инвазивной диагностике решается индивидуально, в то время как безвредные неинвазивные исследования желательно производить у всех беременных женщин.
VI. Биопсия хориона
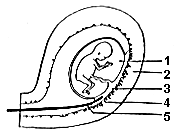 | Схема проведения биопсии хориона: 1. Плодный пузырь 2. Стенка матки 3. Ворсинки хориона 4. Эпителий матки 5. Щипцы для биопсии |
 | Схема проведения амниоцентеза: 1. Плод 2. Стенка матки 3. Шприц для аспирации амниотической жидкости 4. Амниотическая жидкость 5. Влагалище |
Это инвазивный метод пренатальной (дородовой) диагностики. Суть метода такова: под контролем ультразвукового сканирования в канал шейки матки беременной женщины вводится тоненькая трубочка (катетер). Врач осторожно продвигает трубку по направлению к плодному яйцу. Перемещение трубки отслеживается на экране ультразвукового аппарата. После соприкосновения конца катетера с хорионом (так называют специальные ворсинки на конце пуповины, которые соединяют ее со стенкой матки), в него с помощью шприца насасывается очень небольшое количество хориональной ткани. Именно эта ткань (а не ткань собственно зародыша) исследуется в лаборатории разными методами.
Есть еще один способ забора хориона: при этом образец ткани засасывают в шприц через длинную иглу, введенную в полость матки через брюшную стенку женщины. Естественно, тоже под контролем ультразвукового аппарата.
Биопсия хориона дает возможность определять наличие синдрома Дауна и других хромосомных болезней у плода. Результаты получают в течение 3-4 дней после взятия материала. При наличии молекулярно-генетической лаборатории возможна диагностика генных болезней. Попутно можно определить и пол плода. Процедура занимает немного времени и проводится в амбулаторных условиях (т.е. без госпитализации женщины).
Биопсию хориона проводят на сроках 10 - 11 недель беременности. Именно в этот период отмечается достаточная результативность и безопасность метода. Вообще же надо сказать, что возможны осложнения после проведения этой процедуры.
| Риск выкидыша (от 2 до 7% по материалам разных клиник) |
| Риск инфицирования плода (низкий) |
| Риск кровотечения у женщины (низкий) |
Поэтому биопсия хориона назначается лишь в том случае, когда риск тяжелой болезни у плода является сопоставимым с риском выкидыша после биопсии. И уж конечно, не следует прибегать к этому исследованию только ради определения пола плода.
Главное достоинство биопсии хориона заключается в том, что диагноз тяжелой инвалидизирующей болезни у плода можно установить в период до 12-й недели беременности. На этом сроке прерывание беременности происходит с меньшим количеством осложнений для женщины, к тому же уменьшается стрессовая нагрузка на членов семьи.
Направление на биопсию хориона чаще всего дает врач-генетик. Учитывая то, что перед процедурой необходимо пройти некоторое обследование (анализы крови, мазков и проч.), лучше обратиться в медико-генетическую консультацию как можно раньше.
VII. Амниоцентез
Это также инвазивный метод дородовой диагностики. При проведении амниоцентеза под контролем ультразвукового аппарата (чтобы не задеть плод) в полость матки вводится игла со шприцом (путем прокола брюшной стенки женщины). Через иглу в шприц набирают околоплодную жидкость.
В лаборатории можно исследовать как саму жидкость (ее химический состав), так и клетки плода, которые обычно в ней плавают. В околоплодных водах находятся слущенные клетки кожи плода, эпителиоциты из мочевыводящих путей и т.д. Поэтому возможности амниоцентеза несколько больше, чем биопсии хориона. Кроме диагностики хромосомных и генных болезней возможно также:
| Определение степени зрелости легких плода |
| Определение кислородного голодания плода |
| Определение тяжести резус-конфликта между матерью и плодом |
| Более эффективная диагностика наследственных болезней обмена веществ |
| Диагностика пороков развития (например, дефектов закрытия нервной трубки) |
Риск потерять плод после проведения амниоцентеза несколько меньше, чем таковой при биопсии хориона. Этот риск всего на 0,5-1% выше, чем у беременных, которым амниоцентез не проводился вообще. Нежелательным моментом является длительное воздействие ультразвука на плод. Несколько повышается риск рождения маловесного ребенка и совсем слабый (менее 1%) риск дыхательных расстройств у новорожденного.
Амниоцентез обычно проводят на 15 - 16 неделе беременности. Показания для его проведения устанавливает обычно врач-генетик в ходе медико-генетического консультирования.
VIII. Плацентоцентез и кордоцентез
Это также методы инвазивной дородовой диагностики. Техника их проведения универсальна: прокол иглой передней брюшной стенки женщины и под контролем ультразвукового аппарата взятие кусочка плаценты (при плацентоцентезе) или пуповинной крови плода (при кордоцентезе).
Плацентоцентез проводят обычно во втором триместре беременности, как и амниоцентез. Кордоцентез чаще выполняют после 20 недели беременности. Обе процедуры зарекомендовали себя как достаточно безопасные для женщин и плодов. Исследования выполняются под наркозом, амбулаторно или с кратковременной госпитализацией.
Диагностические возможности кордоцентеза несколько больше, чем плацентоцентеза. И тот, и другой методы позволяют диагностировать синдром Дауна и другие болезни, связанные с изменением количества и качества хромосом, а при наличии молекулярно-генетической лаборатории - и многие генные болезни.
Осложнения после плацентоцентеза и кордоцентеза бывают очень редко. Это существенное достоинство данных методов. Недостатком же является большой срок беременности, на котором эти исследования проводятся. В случае потверждения диагноза грубой патологии, прерывание беременности в этот период требует длительной госпитализации и чревато осложнениями.
Показания к проведению этих исследований устанавливает обычно врач-генетик в ходе медико-генетического консультирования.
Скрининг материнских сывороточных факторов (СМСФ)
Это неинвазивный метод дородовой диагностики некоторых тяжелых заболеваний у плода. За рубежом его часто называют "тройным" тестом, поскольку при его проведении исследуется содержание в крови беременной женщины трех веществ: альфа-фетопротеина (АФП), хорионического гонадотропина (ХГ) и неконъюгированного эстриола (НЭ).
АФП - это вещество, которое вырабатывается печенью плода, а затем через плаценту попадает в кровь беременной женщины. В случаях, когда у плода имеются некоторые тяжелые пороки развития, приводящие к смерти или инвалидности (черепно-мозговые или спинномозговые грыжи, называемые дефектами закрытия нервной трубки, а также незаращение предней брюшной стенки и т.д.) анализ показывает значительное повышение уровня АФП в крови матери. И наоборот, при синдроме Дауна у плода, уровень АФП в крови матери сильно снижается.
Определенную помощь в диагностике синдрома Дауна оказывает определение в крови женщины уровней и двух других веществ - ХГ и НЭ. В случае болезни у плода они также отклоняются от нормальных значений. Иногда "тройной тест" дополняют : исследуется также уровень нейтрофильной щелочной фосфатазы (НЩФ) в крови матери. При синдроме Дауна у плода этот уровень выше, чем при беременности здоровым плодом.
Кровь для исследования чаще всего берется из локтевой вены будущей мамы дважды: на сроке 15 недель и через 1-3 недели с таким рассчетом, чтобы второй забор крови был не позже 20 недели беременности.
На результаты анализов оказывают влияние разные ситуации - например, беременность двойней, особенности женского организма, акушерские проблемы. Поэтому оценивает результаты анализа только врач, в каждом конкретном случае делая поправки на эти ситуации. Во всех подозрительных случаях назначается уточняющее обследование - ультразвуковое сканирование, амниоцентез, плацентоцентез или кордоцентез.
В развитых странах, а также в передовых регионах России все беременные женщины проходят этот тест. Его эффективность достаточно большая: 70% всех случаев синдрома Дауна и дефектов закрытия нервной трубки можно выявить на сроках 15-22 недели беременности. При дополнительном исследовании НЩФ процент выявления плодов с синдромом Дауна достигает 80. Это дает возможность прервать беременность без особых осложнений, если семья настроена это сделать.
IХ. Ультразвуковое исследование (УЗИ)

При проведении этого исследования на поверхность живота беременной женщины устанавливается специальный датчик (трансдюсер), который испускает звуковые волны высокой частоты. По достижении тканей плода эти волны отражаются и улавливаются датчиком снова. Компьютерная обработка этих волн и формирует изображение на экране монитора. Изображение называется сонограммой. Иногда используют датчик, который вводится во влагалище женщины (чаще - на ранних сроках беременности).
Конечно, без соответствующей подготовки на сонограмме очень трудно что-либо различить. Однако опытный врач, используя УЗ-аппарат высокой разрешающей способности видит очень многое - даже движения языка и век плода.
Потенциальное вредное воздействие ультразвукового сканирования на организм плода несопоставимо с воздействием, например, рентгеновского излучения. По крайней мере, группа экспертов Всемирной Организации Здравоохранения признала четырехкратное ультразвуковое исследование плода во время беременности безопасным. Однако абсолютно безвредных диагностических процедур не существует в природе, поэтому даже УЗИ не следует чрезмерно увлекаться.

При помощи УЗИ можно определить:
Является беременность маточной или внематочной
Сколько плодов находится в матке - один или несколько
Каков возраст плода (срок беременности) и нет ли отставания в его развитии
Имеются ли у него видимые дефекты (пороки развития)
Какая часть плода предлежит к выходу из таза женщины -голова или ягодицы
Каков характер сердцебиения плода
Пол плода
Где располагается плацента и каково ее состояние
Каково состояние околоплодных вод
Нет ли нарушений кровотока в сосудах плаценты
Нет ли угрозы выкидыша
Ответы на эти вопросы позволяют оценить развитие плода и перспективность данной беременности (стоит продолжать вынашивание или нет?), а также спланировать лечебные мероприятия, тактику родов и т.д.
Стандартные ультразвуковые исследования проводят в разные сроки беременности. В первом триместре это может понадобиться для подтверждения беременности и определения ее характера - маточная или внематочная? УЗИ в последнем триместре беременности помогает врачу выбрать правильную тактику родоразрешения. Однако без этих УЗИ зачастую можно обойтись.
Необходимо помнить, что обязательное ультразвуковое исследование плода должна пройти каждая беременная женщина на сроке 15 - 18 недель. Это УЗИ проводят в женской консультации по месту жительства. Если возникает подозрение на какой-либо дефект развития у плода, делается повторное УЗИ на сроках 22 -23 недели, но уже в медико-генетической консультации. В отдельных случаях возникает потребность в дополнительных УЗИ, но это решает врач в каждой конкретной ситуации.
УЗИ представляет собой совершенно безболезненную процедуру продолжительностью 15 - 20 минут.
Кстати, для того, чтобы изображение плода на экране было более четким, беременной рекомендуется выпить примерно 1,5 литра жидкости за час до исследования и не мочиться, пока сканирование не закончится (наполненный мочевой пузырь улучшает качество исследования).
Конечно, диагностические возможности УЗИ не безграничны. Однако этот метод исследования оказывает огромную помощь врачам и семьям, при этом являясь практически безвредным.
Х. Актуальность проблемы пренатальной диагностики
Каждые 16 минут в России умирает грудной ребенок. Высокая смертность грудных детей , мертворождения,гибель плодов при поздних выкидышах (27-28 недель). Каждую минут выполняется 5-6 абортов. Самая главная задача акушерства - способствовать рождению здорового ребенка.
Лишь 20-30 лет назад началось изучение развития плода в окружающей его сред, что позволилио применть ряд диагностических и лечебных мероприятий для наблюдения за плодом. Перинатальная смертность во многих странах снизилась:
Япония 0.6%
Россия 1.8%
Финляндия 0.8%
Европа 1.2%Таким образом сфоримировалась целая наука котрая нзывается перинатальная медицина основу которой составляют методы пренатальной диагностики поражения плода.
В идеале каждая женщина до беременности нуждается в решении ряда вопросов:
· консультация акушера гинеколога для решения вопроса о том, может ли женщина беременеть вооюще и може ли она выносить эту беременность и родить здорового ребенка. При выявлении непосредственных заболеваний встает вопрос может ли женщина рожать ребенка с наследственной патологией или не рисковать.
· Генетический скрининг до беременности поэтому используются медико-генетическое консультирование, которое может дать прогно, то есть вероятность рождения потомства с генетическими забоелваниями. Особенно должны подвергаться скринингу:
1. женщины с отягощенным акушерским анамнезом (например у женщины родалися ребенок с болезнью Дауна, или пороками развития).
2. Женщины с отягощенным гинеколоигческим анамнезом (пороки развитя гениталий, нарушение менструального цикла, диэнцефальные нарушения).
3. Родственные браки. Часто дают мертворождение.
Наследственная патология может быть с высоким риском ( более 1/10) и с умеренным риском (менее 1/10).
Генетический скрининг осуществляется и во время беременности.
Пренатальная диагностика различных аномалий развития и наследственных заболеваний включает:
1. медико-генетическое консультирование
2. УЗИ-диагностика
3. Биопсия хориона очень важна в плане выявления внутриутробной инфекции плода ( особенно при токсоплазмозе, цитомегаловирусной инфекции).
4. Биопсия кожи плода ( больше в научных целях).
5. Хордоцентез (хорда - пуповина) - взятие крови из пуповины плода. Можено сделать анализ на резус фактор, инфекцию и т.п. можно провести и лечебную процедуру: при изосенсбилизации плода резус-конфликте, когда есть гемолитическая болезнь то можно проивзесте эксфузию крови и замену резус фактора без антител. Можно изучить альфа-фетопротеин - дает возможность определить наличие порока развития плода. Все они имеют положительное и отрицательное значение. Например при хордоцентезе нужно пунктировать брюшную стенку, матку и попасть в сосуды пуповины, делается все это по контролем УЗИ.
1. наблюдение женщин высокого риска и выявление беременных высокого риска. В начале надо уточинть срок, соответствует ли срок состоянию плода, в каком он состоянии. Определение срока по формуле Неделя - первый день последней менструации прибавить 7 дней и отнять 3 месяца получится день родов. Средняя продолжительность беременности 284 дня +/- 14.6 дня.
2. Срок беременности сопоставляется с данными физикального обследования - связь между размреами матки и предполагаемым сроком беременности. Физикальное исследование:
· - выслушивание сердцебиения плода которое начинается с 22-24 недель.
· Ультразвуковое исследование - является объективным методом оценки состояния плода и соответствия размером плода и срока беременности. Биометрия плода по бипариетальному размеру, длина бедренных костей. По таблицам делают заключение. УЗИ используется для выявления аномалий развития так как появление порок развития должно быть выявлено рано (20-21 нед) для того чтобы решить вопрос о продолжении беременности. Выявление задрежки развития плода , гестационный возраст плода, выявление многоплодия, локализация и степень зрелости плаценты,объем амниотической жидкости. Определить плод можно в 4-5 недель, в 7-8 недель. Первые движения в 11 недель (дыхательные движения), 19 недель - глотательные движения, 12-16 недель постоянные движения головой, туловищем, конечностями. На 25 неделе можно видеть сочетание всех видо двигательной активности. Пик движения плода наблюдается между 28 и 34 неделями. К концу беременности активная двигательная функция снижается. Отсутствие или значительное снижение двигательной активности является угрожающим признаком (антенатальная гибель плода). Изучение биофизического профиля плода ( по данным УЗИ, доплерографии - определение кровотока в сосудах плода, маточной артерии. Метод заключается в изменении часоты испускаемых УЗ волн при их отражении от движущейся крови. Разнича между испускаемыми и отраженными частотами называется доплеровский частотны сдвиг. Имеется ваожное клиническое значение - замедление кровотока говорит о хронической гипоксии плода.
· Кардиотокография. Тесты: нестрессовый тест, контрактильный стрессовый тест. Нестрессовый тест - мы наблюдает реакцию сердечно-сосудистой деятельности плода в ответ на его движение. В норме каждое движение плода сопровождается некоторым ускорением его сердцебиения (акселерация сердцебиения). Мы наблюаде за плодом в течение 20 нут, за это время в норме он совершает 2 движения и эти движения сопровождаются акселерацией сердцебиения на 15-20 ударов на кардиотокограмме, у 99% женщин тест является достоверным и является критерием благополучного состояния плода. Если акселерации не происходит то этот тест является либо сомнительным либо отрицательным. Требуется повторить тест. Если опять признаков нет и нет признаков вызывающих неблагополучное состояние плода (отслойка плаценты и т.п). тест повторяют на следующий день, если опять нет акселерации то тест отрицательный. Решается вопрос о лечении, досрочном родоразрешении. Контрактильный тест (окситоциновый тест). Проводится у тех женщин которые имели отрицательный стрессовый тест. Внутривенно вводится 0.5 мл окситоцина на глюкозе одномоментно в ответ на введение всегда возникает сокращнеие матки и должно приосходит ускорения сердцебиения. Если есть ускорение - это норма, если нет то тест считается положительным и требует мер.
· Исследование биохимического профиля плода. - исследование функции плаценты, исследование состояния плода. Наиболее распространенными методами являются определение уровня гормонов и белков беременных - прогестерон, эстриол, плацентарный лактоген, альфа-фетопротеин.
Прогестерон - жнеский половой гормон, стероидный. Синтезируется в яичнике желтым телом. Во время беременности он вырабатывается желтым телом беременности. Когда формируется плацента она берет на себя функцию выработки прогестерона до конца беременности. Это гормон является протектором беременности так как главное биологическое свойство его - поддержание нормотонуса маточной мускулатуры. Дефицит прогестерона наблюдается довольно часо , сообенно в ранних сроках беременности (можно определить с помощью мазка с задней стенки влагалища). Можно определить уровень прогестерона в сыворотке крови, или определить прегнандиол в моче ( метаболит прогестерона). Уровень прогестерона в течение всей беременности должен возрастать. Например при ранних сроках уровень прогестерона 6-7 нг/мл, к концу беременности до 190 нг/мл.
Прогестероновая недостаточность на ранних сроках беременности указывает на угрозу прерыания беременности (тонус матки повышен, матка начинает сокращаться, плод отслаивается). Лечение - введение прогестерона.
Количество прогестерона снижено при плацентарной недостаточности. При этом уменьшена функция плаценты, уменьшен стероидный генез прогестерона. Если снижение от 30 до 80% это говорит о плацентарной недостаточности.
Высокий уровень прогестерона при большой плаценте , которая может быть при сахарном диабете, при многоплодии.
Эстриол. Определяется в моче или плазме. Синтезируется плаценто, главным образом из предшественников. Уровень зависти от состояния плода и целости всего фетоплацентарного комплекса. В течение беременности эстриолг так же нарастает. В 5-8 недели - 0.3- 0.4 нг/мл, в 39-40 неделиь 65 нг/мл.
Плацентарный лактоген (открыт в 1961 году) (хорионический соматотропин). Белковой прирды, синтезируется синцитиотрофобластом. Продукция гомрона повышается с увеличением срока беременности, что отражает увеличение массы плаценты. В норме ранние сроки 3 ммоль/л, в конце беременности 300-320 ммоль/л. Клиническую значимость представляет резкое снижение гормона. При снижении на 50% - прогностически угроза для плода, если уменьшена на 80% - антенатальная гибель плода.
Министерство здравоохранения Украины
Днепропетровская государственная медицинская академия
Кафедра медицинской биологии
Курсовой реферат на тему:
«Профилактика наследственной и врожденной патологии. Пренатальная диагностика»

<