Реферат на тему Жидкостное химическое травление
Работа добавлена на сайт bukvasha.net: 2015-06-25Поможем написать учебную работу
Если у вас возникли сложности с курсовой, контрольной, дипломной, рефератом, отчетом по практике, научно-исследовательской и любой другой работой - мы готовы помочь.

Предоплата всего
от 25%

Подписываем
договор
" " Содержание.
Изотропное травление происходит неупорядоченно, с одинаковой скоростью по всем пространственным направлениям - L и D. Анизотропное травление проявляется при некоторых отклонениях от изотропного процесса. Желательно, чтобы глубина травления (D) была много больше величины бокового подтравливания (L). Поскольку травление в вертикальном направлении при достижении глубины D прекращается, перетравливание определяется только скоростью удаления материала в боковом направлении. Степень анизотропии можно определить как отношение L/D, и ее величина зависит от многих физических параметров. Жидкостное травление определяется в основном статическими характеристиками типа адгезии и степени задубленности резиста, состава травителя и т.п. При сухом травлении степень анизотропии во многом зависит от таких динамических параметров, как мощность разряда, давление и скорость эрозии резиста. Величина бокового подтравливания в случае жидкостного травления зависит от предшествующих стадий обработки - подготовки поверхности и термозадубливания.
wr=wе-2L. (1)
Термодинамика травления. С точки зрения химии процесс травления можно представить схемой твердая фаза+травитель®продукты; при этом к твердой фазе относят кремний, его оксиды и нитриды и многие металлы. Для межсоединений внутри кристалла обычно применяют Al и его сплавы с Si и Cu, причем основным материалом для первого уровня металлизации является Al (табл. 1). Слои оксидов кремния можно выращивать термически, наносить химическим способом или распылением, можно также легировать их фосфором или бором. Металлы используются в виде чистых или пассивированных пленок, сплавов, многослойных структур и интерметаллидов. Поскольку кремний существует в виде монокристаллических или поликристаллических пленок, его структура, как и структура других кристаллических материалов, имеет и ближний и дальний порядок. Поскольку травление переводит упорядоченные структуры в неупорядоченные, термодинамические соображения о поведении свободной энергии DF системы должны учитывать изменения как энтропии +DS, так и энтальпии DН (теплоты растворения или испарения) DF=DН-ТDS. (2) Например, реакция травления аморфного оксида кремния является эндотермической, DН=+11 ккал/моль: SiO2(тв.)+6HF(ж.)®Н2SiF6+2H2O. (3) Таблица 1. Материалы полупроводниковой электроники.
Таблица 2. Влияние ориентации на травление кремния.
Реакция эта трехстадийная: М(тв.) ®М(газ) сублимация, (5) М(газ) ® Мn+(газ)+ne ионизация, (6) Мn+(газ)+Н2О ® Мn+(ж.) гидратация. (7) Изменение энтальпии при сублимации и ионизации положительно (эндотермические реакции), но гидратация экзотермична (отрицательное DН). При газофазном травлении для распыления металла путем его сублимации кинетическая энергия частиц травителя (энергия травления) должна передаваться металлу из газовой фазы. При погружении металлического образца в раствор, содержащий его собственные ионы (уравнение 4), ионы металла переходят в раствор (рис. 5), и образец приобретает отрицательный заряд. Метал образует, таким образом, свой собственный анод. и ионы Мn+ притягиваются к нему, формируя двойной электрический слой (слой Гельмгольца). разность потенциалов в нем называется абсолютным электродным потенциалом.
ne+ Xn- ®Xn. (8) итоговое приращение свобод-ной энергии, DF, составляет DF=-nФDЕ, (9) где DЕ есть разность анодного и катодного потенциалов, аФ-число Фарадея. Величина изменения свободной энергии зависит от: чистоты металла, его кристаллической структуры, наличия напряжений, метода осаждения и состава примесей; активности ионов металла в растворе; ионной силы электролита; температуры; состава растворителя. При травлении диэлектриков переноса электронов не происходит, и реакции в этом случае имеют кислотно-основный характер: SiO2+6HF®H2SiF6+2H2O, (10) SiO2+CF4(газ)®SiF4+CO2. (11) SiѕO-связь заменяется связью SiѕF. Поскольку энергии связей SiѕO и SiѕF близки, знак изменения энтропии определяет, пройдет реакция или нет. Общие принципы кинетики травления. Гетерогенные твердофазные реакции затрагивают различные разделы химии, механики и физики. Типичный процесс включает в себя следующую последовательность реакций: перенос реагента; адсорбция реагента DНads; реакция на поверхности DF; десорбция продуктов DНvap; перенос продуктов. Самый медленный этап определяет скорость реакции. В реакциях низшего порядка Скорость=k нулевой порядок, (12) Скорость=kE первый порядок. (13) скорость зависит от концентрации травителя (Е) только в случае реакции первого порядка. При выборе той или иной реакции травления стараются остановиться на процессе с наименьшим количеством параметров и преимущественно линейными скоростями травления. Желательно также иметь возможность изменения анизотропии регулированием физических параметров и высокую селективность процесса (т. е. отсутствие воздействия травителя на резист или слой, находящийся под стравливаемой пленкой). В реакциях нулевого порядка слабое обеднение травителя несущественно. Однако в реакциях первого порядка мы не имеем достаточного избытка травителя, и он может сильно истощиться при загрузке десяти или более пластин. В реакциях простого порядка зависимость толщины стравленной пленки (или логарифма толщины) от времени линейная. Поэтому окончание реакции может контролироваться и точно определяться экстраполяцией. Рассмотрим механизм переноса для двух основных типов реакций - диффузионно-контролируемых и ограниченных скоростью реакции. Вообще говоря, в процессе травления могут быть вовлечены все три агрегатных состояния вещества: твердая фаза ®скрытая химическая энергия и физическая структура пленки; жидкая фаза ®перенос ионов в жидком диэлектрике, обладающем высокой вязкостью; газообразная фаза®хемосорбция, рекомбинация, ионизация и средний свободный пробег газовых частиц при пониженном давлении Феноменологический механизм травления. Переход от твердой фазы к жидкой или газообразной твердая пленка+ травитель ѕk® продукты (14) зависит от диффузии взаимодействующих веществ SiO2(тв.)+6HF(жидк.) ®H2SiF6+2H2O, (15) SiO2+CF4 ® SiF4+CO2. (16) Пусть r есть соотношение молярных объемов r=(m/d)/(M/D), (17) где m и М - молекулярные веса продукта и травителя, а d и D - соответствующие плотности. Тогда, если r>1 (как при травлении стекла), продукт не покрывает полностью твердую поверхность (рис.6). Поскольку продукт не препятствует проникновению травителя, скорость травления определяется скоростью реакции травителя с твердой поверхностью [k в уравнении 14]. Энергии активации при этом порядка 7 - 20 ккал/моль. В случае r
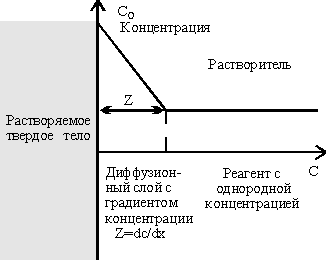
dM/dt=-DSdC/dx, (18) где D - коэффициент диффузии в см2/сек (аналогично коэффициенту температуропроводности).Предполагается, что поперечная площадки (S) не меняется в процессе травления. При жидкостном проявлении, однако, обычно происходит отрывание резиста, что ведет к увеличению S. При ионно-плазменном или реактивно-ионном травлении может происходить эрозия резиста. Из соотношения Эйнштейна-Стокса следует. что коэффициент диффузии D зависит от вязкости (h): D=RT/h, (19) dM/dt=скорость травления =D=1/h, (20) hD=constT, (21) h=exp(Evis/RT), (22) Evis=Eetch. (23) Различают три основных типа твердофазного травления : химический процесс на поверхности идет медленно, и наблюдаемая скорость является скоростью поверхностного процесса [r>1, уравнение 17]; химический процесс на поверхности настолько быстр, что конвекция и диффузия не могут обеспечивать достаточной концентрации реагента у поверхности, r>1. Наблюдаемая скорость является скоростью переноса (диффузии) к поверхности; скорость диффузии и химической реакции одного порядка (потребление реагента в реакции соизмеримо с его переносом в результате диффузии), однако концентрация реагента на поверхности не снижается на столько , чтобы сдерживать реакцию. Простейший пример уравнения для скорости - процесс типа (1) dM/dt= k1SC, (24) где S - площадь поверхности, С - концентрация травителя. Здесь предполагается, что скорость имеет первый порядок по отношению к концентрации травителя, и не учитывается промежуточное поглощение и влияние неровностей поверхности. В реакциях типа (2) необходимо учитывать эффективную толщину (s) слоя градиента концентрации (рис. 8) и применять закон Фика [уравнения 18 и 19]: dM/dt=DSC/s=k2SC. (25) В процессах типа (3) предполагается, что концентрация травителя на поверхности равна Сs (s-ІsurfaceІ): dM/dt=k1SCs=k2S(C-Cs). (26) Если разность эффективных площадей учитывается в k1, то dM/dt=k1k2SC/(k1+k2)=k3SC (27) Уравнения (24), (25), (26) формально представляют одно и то же уравнение, и поэтому необходимо располагать экспериментальным критерием для различения трех описанных типов травления. Некоторые отличия приводятся ниже. Характерными признаками реакции, контролируемой диффузией, являются: Энергия активации зависит от вязкости и равна 1-6 ккал/моль [уравнение 23]. Скорость реакции увеличивается при перемешивании реагента. Исключение составляет эффект автокатолиза NO при травлении кремния в HNO3. Продукты этой реакции (NO) способствуют ее же развитию. Интенсивное перемешивание приводит к уменьшению скорости реакции. Все материалы независимо от ориентации кристаллических плоскостей травятся с одинаковой скоростью. Энергия активации при перемешивании растет. Исключением является травление кремния в HNO3 (DH=100 ккал/моль), в ходе которого значительное количество тепла, выделяемое в результате экзотермической реакции, приводит к увеличению скорости диффузии и скорости травления. Перемешивание в этом случае привело бы к уменьшению скорости травления из-за диссипации тепла. Характерными признаками процессов, контролируемых скоростью химической реакции [уравнение 24], являются: зависимость скорости реакции от концентрации травителя; 2) отсутствие зависимости скорости от перемешивания; 3) энергия активации составляет 8-20 ккал/моль. Жидкостное травление. При жидкостном травлении металлов происходят окислительно-восстановительные реакции, а в случае неорганических оксидов - реакции замещения (кислотно-основные). | ||
Таблица 3. Скорости травления SiO2 в буферном растворе (7;1) HF.
| Метод получения оксида | Относительная скорость травления (мкм/мин) |
| Термоокисление в парах воды1) Анодный рост Пиролитический Распыление Легированный оксид | 1.0 8.5 3-10 0.5 3-5 |
Травление SiO2 в водном растворе HF через фоторезистную маску протекает изотропно благодаря эффекту подтравливания, который усиливается частичным отслаиванием резиста. Почти анизотропные вертикальные профили могут быть получены при использовании твердой и свободной от напряжений масок из Si3N4 (рис. 9). Косые кромки получают при использовании 30:1 (по весу) раствора NH4F в HF. Ухудшение адгезии резиста или, наоборот, его хорошее сцепление (Si3N4) с поверхностью SiO2 может привести к возникновению трех различных профилей травления. Химия травления SiO2 включает нуклеофильное воздействие фторидных групп на связи SiѕO. В буферном растворе HF (7 частей 40-процентной NH4F к одной части концентрированной HF) доминируют два типа частиц:
 |
| Рис. 9. профили полученные при использовании жидкостного травителя 6:1 NH4/HF с различными масками: а-маска Si3N4; б-фоторезистная маска. В случае (в) травление в смеси 30:1 NH4F/HF проводилось через маску фоторезиста. |
F ѕk1® H+ + F-, k1=10-3, (28)
HF+F- ѕk2® HF-2, k2=10-1. (29)
Основной частицей в буферном растворе HF является HF-2. Эта система чувствительна к перемешиванию и, скорее всего, является диффузионно-контролируемой. На рис. 10 показана линейная зависимость скорости растворения от концентрации HF-2 и HF. Таким образом, скорость уменьшения толщины SiO2 равна
d(SiO2)/dt=A(HF)+B(HF-2)+C, (30) где А, В и С - постоянные, при 250С равные 2, 5 и 9.7 соответственно.
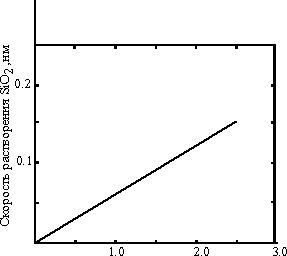 |
| Рис. 10. Линейность скорости растворения SiO2 при 23оС. |
Можно представить, что атака бифторидным ионом поверхности диоксида кремния включает промежуточное состояние
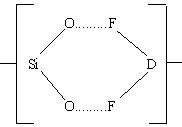 Во взаимодействии HF с оксидом кремния участвуют, вероятно, поверхностные состоянии
Во взаимодействии HF с оксидом кремния участвуют, вероятно, поверхностные состоянии В конце концов фтор замещает кислород. Атомы водорода присоединяются к атому кислорода на поверхности SiO2, а в координационную сферу SiF4 включаются два или более ионов фтора, так что в растворе образуется SiF62-. Окончательно реакция травления может быть представлена как
В конце концов фтор замещает кислород. Атомы водорода присоединяются к атому кислорода на поверхности SiO2, а в координационную сферу SiF4 включаются два или более ионов фтора, так что в растворе образуется SiF62-. Окончательно реакция травления может быть представлена как 6HF + SiO2 ® H2SiF6 + 2H2O (31)
Обнаружено, что при добавлении NH4F и H2F6 к буферному раствору HF скорость травления увеличивается благодаря образованию HF2-. При этом накапливание H2SiF6 конкурирует с процессом образования осадка (NH4)2SiF6 :
H2SiF6 + NH4F ® (NH4)2SiF6 + HF
Добавление более сильных нуклеофильных веществ (NH4Cl, -Br, -I) ведет к увеличению скорости (табл. 4), что свидетельствует о развитии процесса через нуклеофильное смещение. Таблица 4. Влияние галогена на скорость травления SiO2.
| Буферный ион | Скорость травления (нм/сек) |
| F- Cl- Br- I- | 1.0 2.0 2.3 3.3 |
Si + [O] ® SiO2 + 14ккал/моль (33)
и последующее травление SiO2 :
6HF + SiO2 ® H2SiF6 + H2O - 11ккал/моль (31)
В травителе HF/HNO3 происходит реакция
Si+2HNO3+6HF ® H2SiF6+2HNO3+ 2H2O+125ккал/моль (34)
Для растворения каждого атома Si требуется две молекулы HNO3 и шесть молекул HF. Если реакция контролируется диффузией, то максимальная скорость травления должна достигаться при молярном соотношении HNO3 и HF, равном 1:3. Анализ зависимости Аррениуса для травления Si в HF/HNO3 обнаруживает излом (рис. 11), соответствующий изменению вида процесса от диффузионно-контролируемого к контролируемому скоростью реакции. Энергия активации диффузионно-контролируемого травления (6 ккал/моль) определяется диффузией HF через слой продуктов реакции. Значение этой энергии при травлении, контролируемом скоростью реакции (4 ккал/моль), определяется окислением кремния. Для диффузионно-контролируемого процесса произведение вязкость ґ скорость постоянно [уравнение (21)]. Для управления вязкостью добавляется ледяная уксусная кислота (рис.12).
 |  |
| Рис. 11. Зависимость скорости травления dM/dt от величины 1000/Т при травлении Si в HNO3/HF. | Рис. 12. Зависимость произведения вязкости на скорость травления hґ(dM/dt) от температуры ля травления Si при использовании ледяной уксусной кислоты в качестве загустителя. |
Si + 2OH- + H2O ® SiO2 + 2H2 (35)
Этилендиамин, гидразин и OH- действуют как окислители, а пирокатехин и спирты - как комплексообразующие агенты для SiO3+. Кроме того, водород может замедлить травление поликремния. Для удаления H2 с поверхности добавляют ПАВ.
 |
| Рис. 13. преимущественное травление кремния вдоль кристаллографических направлений <100> и <110>. |
 |
| Рис. 14. Анизотропное (а) и изотропное (б) жидкостное травление эпитаксиального кремния. |
п ри добавлении к реагентам 1000 ppm (1 ppm=1часть на миллион) ароматического пиразина достигалось увеличение энергии активации до 11 ккал/моль и селективности травления плоскостей (100) и (111) с 10 до 20. Травление кремния применяется также с диагностическими целями для выявления точечных проколов SiO2. Кремний, легированный бором, травится медленнее нелегированного кремния.
 |
| Рис. 15. Зависимость угла травления поликремния Q от содержания воды в травителе KOH/спирт/Н2О. |
Таблица 5. Изотропное и анизотропное травление кремния.
| Травитель | Скорость травления, мкм/мин | Подтравливание (мкм/сторону)1) | ||||
| PS | ES | BS | PS | ES | BS | |
| Изотропный2) | 3 | 4 | 4 | 1.5d | 1.5d | 1.5d |
| Изотропный3) | 0.8 | 0.6 | 0.5 | 1.0d | 1.0d | 1.0d |
| Анизотропный4) | 0.7 | 0.9 | 1.1 | (0.1-1.0)d | <0.1d | <0.1d |
2) HNO3 (65%)/HF(40%)/NaNO2=95/5 мл/г.
3) HNO3(65%)/H2O/HF(40%)=100/40/6мл.
4) KOH/H2O/n-пропанол=15г/50/15 мл.
Таблица 6. Изотропные травители для кремния.
| Травитель | Применение |
| HF, HNO3, CH3COOH | Все разновидности Si |
| HF, HNO3, CH3COOH | Низкоомный Si |
| HF, KMnO4, CH3COOH | Эпитаксиальный Si |
| HF, HNO3, H2O2+NH4OH | Удаление примесей Cu |
| HF, HNO3, CH3COOH | pnp - многослойные структуры |
| HF, HNO3 | pnp - многослойные структуры |
| NHF, H2O2 | Минимальное подтравливание |
| HF, HNO3, I2 | Общее травление |
| HF, HNO3, CH3COOH | Подтравливание плоскости (100) |
| HNO3, HBF4, NH4BF4 | Маска из резиста AZ-1350 |
| NH4F, H2O2, NH4HPO4 | Скорости травления, Si/ФСС=2/1 |
| KOH+спирт | Поликристаллический Si |
| Травитель | Применение |
| Этиледиамин, пирокатехин, H7O | 100 |
| Этиледиамин, пирокатехин | SiO2, Si3N4, выявление точечных проколов |
| Гидразин, ИПС, H2O | 100, Al-маска |
| КОН, sec-спирты | 100 |
| КОН, этиленгликоль | Текструрирование элементов солнеч-ных батарей |
| Диамины, КОН, ИПС | Не разрушается Al |
| КОН, ИПС, H2O | 100 |
| R3N+OH, ИПС, H2O | 100 |
| R3N+OH, поверхностно-активное вещество | H2 |
| R3N+OH | Устранение Na+ из травителя |
| H3PO4+следы As2O3 | n-тип |
| CuF2, маска из резиста AZ-1350 | Электролитическое травление |
Cкорость травления=А(HF)+B(HF2-)+C (37) Керн и Деккерт всесторонне рассмотрели травление Si3N4. В HF модно получить равные, но небольшие - около 10 нм/мин - скорости травления Si3N4 и SiO2:
подбором температуры и соотношения HF/HF2-. Скорость травления оксида можно снизить до 10 нм/мин, разбавляя 10%-ную плавиковую кислоту. При низкой концентрации HF растворение SiO2 лимитируется не скоростью реакции, а диффузией (4 ккал/моль). Подбирая температуру смеси фосфорной или фторборной кислот, можно довести скорости травления SiO2 и Si3N4 до 10 нм/мин. Фосфорная кислота, однако, разрушает нижележащие слои Si и Al, что может быть уменьшено добавлением серной кислоты. Добавка диолефинов также предотвращает разрушение нижележащего слоя Al.
 |
| Рис.16. Травление сандвича Si3N4/SiO2: а-большая скорость травления SiO2; б-изотропное травление с одинаковыми скоростями. |
В другом подходе, включающем в себя обратное травление, используется слой вольфрама, нанесенный поверх SiO2/ Si3N4 и прорисованный через резистную маску. Сначала подтравливается слой оксида, затем удаляется W, и слой Si3N4 профилируется через оксидную маску с требуемой топологией. Компромиссным составом для травления сандвича резист / Si3N4/ боросиликатное стекло является смесь 70% H3PO4, 29% глицерина и 1% HBF4 при температуре 103оС. При более высоких концентрациях HBF4 наблюдается быстрая эрозия резистов KTFR и AZ-1350.
Травление алюминия. Жидкостное травление металлов включает в себя многие электрохимические процессы. Химическая реакция вызывает протекание тока, причем металл является анодом
M ® Mn+ + ne. (38) Большинство металлов покрыто естественным окислом. Для удаления этого пассивирующего слоя добавляется вспомогательный травитель.
Известно большое число различных неорганических окислителей. Наиболее простые содержат Н+. Основная задача химика-технолога заключается в выборе подходящего окислителя, удовлетворяющего требованиям термодинамики:
DF = -nФDЕ, (39) где DF - свободная энергия, DЕ - разность потенциалов окисления и восстановления (табл. 8).
Таблица 8. Металлы и окислители.
| Металл | Окислитель | Металл | Окислитель |
| Al | F2 | Sn | Br2 |
| Zn | H2O2 | Cu | HNO3 |
| Cr | MnO4- | Ag | Fe2+ |
| Ni | Cr2O72- | Au | I2 |
Металлы при контакте друг с другом изменяют свой электрохимический потенциал [см. формулу (38)] (гальванический эффект), что ускоряет их собственное травление и ведет к сильному подтравливанию нижележащего металлического слоя. Например, слой Al в NaOH стравливается сам по себе за 7 мин. При контакте с Pt/Au его травление оканчивается через 1 мин.
Травители для алюминия. Травление алюминия проводится в щелочной или кислотной среде. Широко применяется травитель, состоящий из концентрированной H3PO4 (76%), ледяной уксусной кислоты (15%), концентрированной азотной кислоты (3%) и воды (5%) по объему. Согласно исследованиям, процесс состоит из двух стадий - формирования Al3+ и образования AlPO4, контролируемых скоростями соответствующих реакций:
Al2O3 ѕмедленно® Al ѕ-3еHNO3® Al3+ ѕбыстро®
ѕбыстро® Пленка ѕмедленно® Растворимый AlPO4. (40)
Вода в фосфорной кислоте препятствует растворению Al2O3, но она способствует растворению вторичного продукта AlPO4. Сила тока пропорциональна скорости травления. Если ток приложен к алюминию, то отмечается анизотропия травления.
Энергия активации травления Al в H3PO4/HNO3 равна 13.2 ккал/моль, что предполагает ограничение процесса скоростью растворения Al2O3 в H3PO4. Выделяемый газ есть смесь Н2, NO и NO2. Адсорбция газов на поверхности Al является постоянной проблемой при использовании вязких травителей. Пузырьки способны замедлять травление - под ними образуются островки недотравленного металла, которые могут замыкать близко расположенные проводники.
 |
| Рис. 17. Образование пузырьков во время жидкостного травления пленки железоникелевого сплава. Преимущест-венная адсорбция газообразных продуктов на боковой стенке ограничивает боковое подтравливание. |
Для снижения бокового подтравливания Al с 1.0 до 0. 25 мкм было предложено несколько травителей (табл. 9), содержащих добавки сахарозы (полиспирта) и ПАВ.
Таблица 9. Травители для алюминия.
| Травитель | Резист1) | Применение |
| 1. Na3PO4, Na2CO3, K3FeCN6 | ДХН, АК | Уменьшение подтравливания до 0.5 мкм |
| 2. K3FeCN6 | АК | Минимизация количества пузырьков |
| 3. H3PO4, HCLO4, H2O, ПАВ | ДХН,АК | Уменьшение подтравливания |
| 4. H3PO4, HNO3, ПАВ, сахароза | АК | Подтравливание 0.25 мкм |
| 5. HCl | АК | Все гальванически осажденные металлы, включая Al; |
| 6. HCl, HNO3, Cu(NO3)2 | травление распылением электролита, устранение подтравливания | |
| 7. Щелочь, изопропанол | Устранение неоднородности травления Al/Cu | |
| 8. ДНХ-проявитель | Универсальный травитель Al разрушается при достаточной концентрации проявителя |
Некачественно травление Al обусловлено несколькими факторами :
недопроявленный резист; неравномерность толщины; напряжения в пленках поверх ступенек; гальваническое ускорение травления из-за наличия преципитатов Al-Cu; неравномерность толщины окисла; нестабильность температуры (>±1оС). Эти факторы приводят к перетравливанию и закорачиванию.
Хром является вторым после алюминия металлом, наиболее часто подвергающимся травлению. Он широко используется при изготовлении фотошаблонов. В качестве травителя используется сульфат церия/HNO3.
Вследствие индукционного эффекта (формирования верхнего слоя Cr2O3) травление пленки нелинейно, и поэтому момент окончания травления не может быть определен по ее начальной толщине.
Электрохимическое травление. Прикладывая потенциал к металлу, покрытому резистной маской, можно перенести рисунок в материал в более мягких травителях, чем при травлении в химически равновесных условиях. Платина, например, обычно травится в горячей царской водке (HCl/HNO3), которая снимает большинство резистов. Подавая потенциал 1.0 В, можно травить платину в разбавленной HСl. В технологии предпочтительнее электрохимические процессы, так как для них точнее определяется момент завершения травления (рис. 18), их легко автоматизировать, применяя оборудование для электроосаждения. Подложки являлись анодом в ячейке, к которой прикладывалось напряжение (рис. 18). Ток ячейки быстро поднимается до пикового значения вслед-ствие поляризации электролита и затем снижается до стационарного значения Iо.
 |
| Рис. 18. Автоматизация определения окончания процесса путем контроля тока I при электро-химическом травлении. |
Практические аспекты жидкостного химического травления. Практические аспекты жидкостного химического травления (ЖХТ) связаны со статическми и динамическими характеристиками этого процесса, а также с его конечными результатами.
Таблица 10. Аспекты ЖХТ.
| Статтистические характеристики | Динамические характеристики | Результаты ЖХТ |
| Однородность пленки | Разбрызгивание травителя | Подтравливание |
| Состав пленки | Перемешивание травителя | Проколы |
| Молярность травителя | Скорость травления | Закорачивание, разрывы |
| Состав травителя | Эрозия резиста | Допуск на изменение размеров |
| Размер изображения в резисте | Ослабление адгезии | Селективность |
| Температура | Момент прекращения травления | Наклон стенок |
| Объем травителя | Истощение травителя | Изменение размеров |
SiO2 + 6HF ® H2SiF6 + 2H2O. (41)
Полагаем падение скорости травления на 20% предельным, что соответствует уменьшению концентрации HF также на 20% (рис.10). Для пленки SiO2 толщиной t=0.5 мкм и плотностью r вычисляем количество удаленных молей SiO2:
Моли SiO2 = p r2 t r/ SiO2 = = 3.14(25 см2) 5Ч10-5 см(2.3 г/см3)/60 (42)
На одну пластину требуется 4.8Ч10-4 молей HF, следовательно, в нашей ванне с учетом 20%-ного падения скорости (это соответствует 3.2 молям HF) можно обработать 25000 подложек. Если производительность установки равна 500 пластин в день, то раствор в танке придется менять раз в 50 дней (если пренебречь потерями материала и загрязнениями). Заключение. Травление - критическая стадия литографического процесса. На этой стадии жестко испытываются адгезия, непроницаемость, уровень дефектности и химическая инертность резиста. Стойкость резиста к травлению и его адгезия к подложке являются, возможно, наиболее важными параметрами резистного литографического процесса и в наибольшей степени определяют его успех. Применение резиста с высокой стойкостью к травлению гарантирует минимальное искажение изображения при переносе его в подложку. Практические пределы применимости процесса ЖХТ определяются его разрешением -1.5-2.0 мкм - и уходом размеров при травлении - ±0.2-0.5 мкм. Список литературы. Травление полупроводников [сборик статей]. Пер. с англ. С. Н. Горина. М.: Мир, 1965. Перри Дж. Справочник Инженера-химика/ Пер. с англ. - Т.2. - М.: Химия, 1969. Полтавцев Ю. Г., Князев А. С. Технология обработки поверхностей в микроэлектронике. - Киев: Тэхника, 1990. Технология полупроводниковых приборов и изделий микроэлектроники.[Учеб. для ПТУ: в 10 кн.]. - М: Высш. шк., 1989. Авдеев Е. В., Колтищенков В. М., Пантелеева Т. С. Двумерное топологическое модерирование травления//Электронная промышленность. - 1986.- №4.-С.14-17. Голосов В. В. Электрохимическое травление GaAs. В сб.: Силовые п/п приборы. - Талин : Валгус, 1981. Васильева Н. А., Ерофеева И. Г. Электрохимическое полирование подложек GaAs// Электронная промышленность. -1988.-№8.-С. 39-40. Киреев В. А. Краткий курс физической химии. М.: Химия, 1978.