Реферат на тему Создание биологического водителя ритма сердца
Работа добавлена на сайт bukvasha.net: 2015-06-29Поможем написать учебную работу
Если у вас возникли сложности с курсовой, контрольной, дипломной, рефератом, отчетом по практике, научно-исследовательской и любой другой работой - мы готовы помочь.

Предоплата всего

Подписываем
Майкл Розен (Michael R.Rosen), доктор медицины
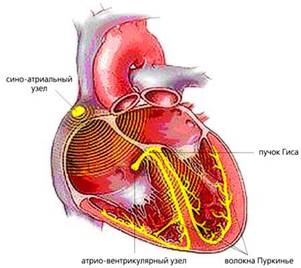
По смертности сердечно-сосудистые заболевания по-прежнему занимают ведущее положение в мире. Одни из самых распространенных сердечных патологий - аритмии, причинами которых могут быть различные функциональные и органические поражения миокарда (прежде всего инфаркт, ишемическая болезнь, врожденные или приобретенные пороки сердца и т.д.). В нормально работающем сердце ритмические сокращения миокарда происходят под действием импульсов, которые спонтанно зарождаются в клетках сино-атриального узла (рис.1). Иначе он называется первичным водителем ритма, или пейсмекером (англ. pacemaker - задающий ритм). От него возбуждение распространяется по предсердиям, заставляя их синхронно сокращаться и перекачивать кровь в желудочки, и доходит до атрио-вентрикулярного узла. Далее электрический импульс через пучок Гиса достигает его конечных разветвлений - волокон Пуркинье - и вызывает сокращение желудочков, вследствие чего кровь изгоняется из сердца в органы и ткани организма.
Рис.1. Схема расположения водителя ритма и проводящей системы в сердце.
Если по той или иной причине возбуждение сино-атриального узла не возникает либо не может перейти на предсердие, его роль выполняют пейсмекеры второго порядка, локализованные в предсердии или в атрио-вентрикулярном соединении. При полной поперечной блокаде, когда проведение возбуждения от предсердий к желудочкам полностью нарушено, включаются пейсмекеры, расположенные в проводящей системе желудочков. Если и этого не происходит, то прекращение кровообращения в результате остановки желудочков может привести к необратимому повреждению мозга и даже смерти.
При полном нарушении автоматизма сердца возбудимость миокарда все же сохраняется в течение некоторого времени, и тогда на помощь приходят искусственные водители ритма - кардиостимуляторы. Хотя за почти полувековое использование (первый портативный водитель сердечного ритма с батарейным питанием был разработан в 1957 г.) электронные пейсмекеры проявили себя очень хорошо, тем не менее у них есть ряд недостатков. Во-первых, они не регулируют реакцию сердечной мышцы на физические и эмоциональные нагрузки. Во-вторых, в случае, когда, например, болен ребенок, имеет значение масса кардиостимулятора и размеры его электродов, которые зачастую не соответствуют росту и развитию пациента. В-третьих, из-за локализации пейсмекерного электрода в сердце не всегда удается добиться оптимальной активации возбуждения и сокращения. В-четвертых, искусственные водители ритма периодически должны тестироваться и требуют замены батареек каждые 5-10 лет, т.е. практически повторной операции. И наконец, некоторые приборы (в том числе и медицинские - например, томографы) могут влиять на работу электронного пейсмекера.
Словом, как бы ни были хороши даже самые современные кардиостимуляторы, поиск альтернативы необходим. Одно из перспективных решений - биологический водитель ритма, который может работать неограниченное время, отвечать на физиологические команды, меняя сердечный ритм в зависимости от условий и активируя сердце с учетом специфики заболевания любого человека. Активное развитие в последнее десятилетие генной и клеточной терапии позволяет надеяться, что такой биологический пейсмекер будет создан и в кардиологии появится новый способ лечения аритмий [1].
Во всех исследованиях по созданию биологических пейсмекеров применялись два подхода: введение специфических генов в составе плазмидных или вирусных векторов и использование различных типов стволовых клеток. При планировании работ принимались во внимание следующие характеристики сино-атриального узла:
- слагающие его клетки специализированы, т.е. предназначены для инициации сердечных сокращений [2];
- спонтанная генерация импульсов соответствует физиологическим и эмоциональным потребностями организма, что обусловлено взаимодействием ионных каналов и насосов [3];
- распространение импульсов должно быть оптимальным для активации сокращения.
При разработке стратегии исследований учитывалось, что формирование спонтанных импульсов в сино-атриальном узле происходит в результате активации специального тока If, каналы которого открыты более сотни миллисекунд, а изменение этого тока во времени хорошо подстраивает ритм сердца [4, 5]. В пейсмекерный ток вносят вклад и входящие (например, INa), и выходящие (IK) токи, а также их взаимодействие, при котором увеличение входящего тока и/или уменьшение выходящего приводит к учащению ритма сердца [3, 6-10].
Генная терапия
Влияние на автоматизм сердца симпатической нервной системы, которое опосредовано действием ее медиаторов (адреналина и норадреналина), хорошо изучено. В связи с этим первые работы по созданию биологических пейсмекеров были направлены на активацию b-адренорецепторов, что приводит к фосфорилированию мембранных белков и усилению входящих токов. Исследователи надеялись добиться повышения автоматизма сердца в результате введения в предсердие свиньи специально сконструированного плазмидного вектора с геном, кодирующим 2-адренорецептор [11, 12]. Действительно, ритм предсердий стал достоверно выше исходного уровня. Казалось, путь к успеху проложен, однако эффект длился всего около 24 ч, и не было уверенности, что, продолжая исследования в этом направлении, можно добиться устойчивой работы водителя ритма. Неясно было даже, что в данном случае произошло - коррекция существующей пейсмекерной активности или формирование новой.
Следующим шагом стали эксперименты, в которых попытались воздействовать на выходящий, гиперполяризующий ток IK [13, 14]. Для этих целей использовали аденовирусный вектор со встроенным мутантным геном Kir 2.1, кодирующим одну из белковых субъединиц калиевого канала [13]. Эту генную конструкцию вводили в полость левого желудочка морской свинки, что привело спустя 3-4 дня к подавлению калиевого тока IK на 80%. В течение этого времени спонтанный ритм регистрировался на электрокардиограмме, и потенциалы действия кардиомиоцитов выявили его высокий уровень. Главный недостаток такого подхода заключается в том, что подавление тока IK само по себе могло стать причиной аритмии. К тому же неясно, какой из входящих токов обеспечивал пейсмекерную функцию сердца в данном случае, поэтому последствия таких работ непредсказуемы [15].
Стратегия экспериментов, проведенных в нашей лаборатории, была направлена на повышение интенсивности пейсмекерного тока If (или тока автоматизма), который в норме генерируется только в клетках сино-атриального узла. Этот смешанный ток (формируется как ионами натрия, так и ионами калия) уникален по своей природе, так как это единственный ток, который не увеличивает длительности потенциала действия и регулируется автономной нервной системой [16, 17]. Известно также, что каналы, пропускающие If, состоят из белков семейства HCN (Hyperpolarization activated, Сyclic Nucleotide gated - активируются гиперполяризацией, а состояние ворот - открытие и закрытие - зависит от циклических нуклеотидов). Ген НСN2 встроили в аденовирусный вектор и ввели в клеточную культуру, что привело не только к повышению If, но и значительному увеличению количества бьющихся клеток [18]. Более того, при воздействии на них изопротеренолом (синтетическим аналогом катехоламинов) эти клетки отвечали положительным хронотропным эффектом (ускорением сердечного ритма) и отрицательным хронотропным эффектом на ацетилхолин, как обычно и происходит в здоровом организме. Значит, эти клетки потенциально способны отвечать на физиологические команды [19].
Эксперименты продолжили на собаках, которым с помощью катетера вводили в левое предсердие аденовирусную конструкцию - AdHCN2 и AdGFP (GFP - green fluorescent protein - зеленый флуоресцирующий белок, ген которого используется для синтеза цветной “метки”). Затем стимуляцией блуждающего нерва (под наркозом) добились угнетения синусового ритма. Спустя четыре дня в области инъекции аденовируса возник новый ритм, чего не происходило у контрольных животных, которым вводили только AdGFP или физиологический раствор [20]. Более того, в дезагрегированных клетках сердечной мышцы, полученных из места инъекции, выявлен пейсмекерный ток в 100 раз большей плотности по сравнению с нативными кардиомиоцитами.
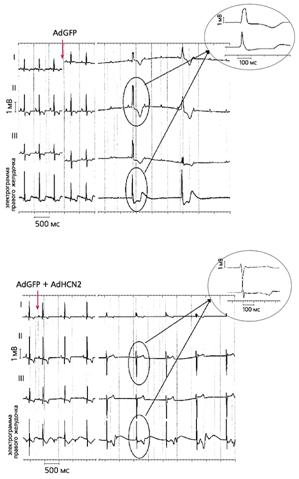
Повторное введение AdHCN2 в желудочковую проводящую систему тех же собак спустя четыре-семь дней при угнетении синусового ритма приводила к появлению в месте инъекции устойчивого ускользающего ритма - около 60 ударов в минуту, более частого по сравнению с контролем (рис.2) [21]. Повышенная экспрессия HCN2 подтверждена с помощью иммунохимических и биофизических методов [22].
Рис.2. ЭКГ собак, которым вводили аденовирусные конструкции с геном GFP (верхняя запись) и генами GFP и HCN2 [21].
До инъекции синусовый ритм у обеих собак был примерно одинаков. После его угнетения, что было вызвано стимуляцией блуждающего нерва (время стимуляции отмечено стрелками), возникал идиовентрикулярный ритм, причем у животного, которому вводили оба гена, он был учащенным и возникал быстрее по сравнению с контролем. На увеличенных фрагментах записей видно, что в первом случае (AdGFP + AdHCN2) возбуждение зарождается в левом желудочке, а во втором (AdGFP) - в правом.
Безусловно, из всех перечисленных подходов генной терапии обнадеживают только результаты последнего, поскольку только в этом случае возникал стабильно ускользающий идиовентрикулярный (собственно желудочковый) ритм приемлемого физиологического уровня и получены доказательства ответов вызванного ритма на активацию автономных нервов и их медиаторов. И все же выбранная стратегия вызывает некоторые сомнения, так как после прекращения синусового ритма и до появления идиовентрикулярного проходит от 5 до 30 с, что с клинической точки зрения недопустимо. Неясно также, удастся ли с помощью инъекции аденовирусной конструкции добиться продолжительной активности или она будет сохраняться лишь дни или недели. Сомнения вызваны кратковременной экспрессией гена, что связано со свойствами аденовируса, в который его встраивают. Дело в том, что в ядре клетки-мишени геном аденовируса существует преимущественно в эписомальной форме, т.е. в виде кольцевых внехромосомных молекул, которые в каждом цикле деления подвергаются репликации с помощью ДНК-полимеразы клетки. Вирусная ДНК может встраиваться в линейной форме в геном инфицированной клетки, тем не менее число эписомальных копий вирусной ДНК будет значительно больше, чем интегрированных, что активизирует иммунную систему и приведет к возвращению преобразованной клетки в исходное состояние. Кроме того, аденовирусы - причина обычной простуды, поэтому, возможно, некоторые люди будут уже иметь достаточно высокие уровни антител к аденовирусному капсиду (покрывающему белку), что затруднит попадание AdHCN2 в клетку. Другие вирусные векторы, например, РНК-содержащие ретровирусы, хотя и обладают некоторыми преимуществами (эффективностью передачи, геномной интеграцией, стойкой экспрессией) потенциально патогенны, поскольку обладают онкогенными последовательностями.
Клеточная терапия
Открытие способности эмбриональных стволовых клеток трансформироваться по меньшей мере в 350 различных типов клеток послужило толчком к активному их изучению и открыло перспективы их использования в биологии и медицине, в том числе и кардиологии. Однако предстояло научиться идентифицировать и выделять клетки-предшественники, которые после дифференцировки могут стать клетками необходимой линии. Опубликованные в 1999 г. в “Science” результаты экспериментов Д.Томсона и Дж.Беккера, которым удалось выделить человеческие эмбриональные стволовые клетки и получить первые линии специализированных клеток, были признаны третьим по важности событием (после открытия двойной спирали ДНК и расшифровки генома человека) в биологии ушедшего столетия.
Когда выяснилось, что определенные подтипы эмбриональных стволовых клеток генерируют импульсы, сходные со спонтанными импульсами истинных водителей ритма, попытались использовать эти клетки в качестве биологических пейсмекеров [22]. Но и здесь возникло немало проблем.
Во-первых, поскольку незрелые эмбриональные стволовые клетки после прекращения дифференцировки могут утратить пейсмекерные характеристики, было бы большим достижением, если бы удалось останавить развитие полученных кардиомиоцитов на стадии сино-атриальных клеток.
Во-вторых, важно выяснить, какие каналы определяют спонтанный ритм пересаженных клеток, и убедиться, что это именно те каналы, которые обеспечивают работу истинных водителей ритма в сердце человека. Кроме того, надо знать, как созданная конструкция будет отвечать на стимуляцию вегетативных нервов, т.е. определить чувствительность новых кардиомиоцитов к автономным нервным воздействиям. Эти вопросы возникли в связи с потенциальной аритмогенностью создаваемых водителей ритма [23]. Ответив на эти вопросы, можно понять: развитие аритмии в данном случае - артефакт (например, следствие экспериментальных манипуляций) или потенциально опасное свойство биологических пейсмекеров, созданных на основе эмбриональных стволовых клеток. И наконец, не решена проблема иммунного ответа организма на присутствие завершивших дифференцировку клеток. В этом отношении более перспективны, на наш взгляд, мезенхимальные стволовые клетки, которые, как и эмбриональные, полипотентны (т.е. способны дифференцироваться в ряд клеточных линий, включая клетки скелетных мышц и клетки соединительной ткани), но при этом, по-видимому, обладают “иммунопривилегированностью” - на последних стадиях развития не вызывают существенного иммунного ответа [24].
Изначально стволовые клетки были обнаружены в костном мозге взрослого организма (точнее, в мезенхиме, или строме, костного мозга). Впоследствии оказалось, что они присутствуют практически во всех органах взрослых животных и человека; тем не менее обычно их выделяют из костного мозга. Таким образом, появилась заманчивая перспектива: создание банка мезенхимальных стволовых клеток для клеточной терапии различных патологий. В случае, когда по каким-либо причинам нельзя использовать донорские стволовые клетки, их источником может служить собственный костный мозг пациента. Однако до того как это будет введено в практику, необходимо более тщательно изучить биобезопасность, в частности “иммунопривилегированность”, стволовых клеток.
Мы рассматривали мезенхимальные стволовые клетки взрослого человека в качестве основного экспериментального материала. Прежде всего нас привлекли стабильность клеточных линий и их низкая антигенность. Однако мезенхимальные стволовые клетки человека не способны генерировать пейсмекерный ток If, поэтому необходимо было нагрузить их геном HCN2, который, напомню, отвечает за трансляцию синтеза белков, формирующих и переносящих If. Сделано это было с помощью метода электропорации: клетки поместили в пульсирующее электрическое поле, благодаря чему временно открывались поры в клеточной мембране, через которые мог проникнуть вирусный переносчик со встроенным геном HCN2; при этом эффективность заражения составляла 35-45% [25].
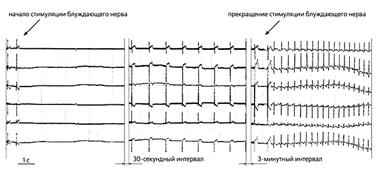
Рис.3. ЭКГ собаки спустя пять дней после имплантации мезенхимальных стволовых клеток человека, содержащих гены GFP и HCN2, в эпикард ее левого желудочка [26]. Слева направо: синусовый ритм до и после начала стимуляции блуждающего нерва, идиовентрикулярный ритм во время вагусной стимуляции и восстановление синусового ритма после прекращения стимуляции блуждающего нерва.
Модифицированные человеческие стволовые клетки с экспрессированным геном HCN2 были пересажены в небольшую область эпикарда левого желудочка собак [25]. Через неделю у них на фоне угнетения ритма сино-атриального узла развились ритмы ускользания с частотой 60 возбуждений в минуту (рис.3). Локализация источника ритма в месте имплантации стволовых клеток определялась с помощью метода флуоресцентного оптического картирования *.
* “Оптические измерения трансмембранного потенциала были задуманы американским исследователем Л.Коэном. Идея основана на свойствах специально синтезированных молекул-флуорофоров, которые, связавшись с клеточной мембраной, способны поглощать и излучать свет с эффективностью, зависящей от величины электрического поля, в котором находится эта молекула. Таким образом, осветив сердце, прокрашенное флуорофором, можно оптически измерить кинетику трансмембранного потенциала по изменениям интенсивности или длины волны флуоресценции. Более того, используя современные методы двухмерной регистрации света, можно составлять карты изменения трансмембранного потенциала на поверхности сердца. Оптическая природа измерений позволяет изменять пространственное разрешение картирования сигналов путем простой замены оптического увеличения. В настоящее время картирование трансмембранного потенциала осуществляется в широком диапазоне пространственного масштаба: от единичной клетки до целого сердца”. (Ефимов И.Р., Самбелашвили А.Т., Никольский В.Н. // Вестник аритмии. 2002. №26. С.91-96.) - Примеч.ред.
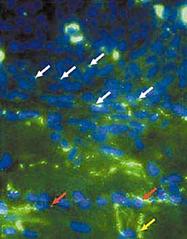
Гистологические исследования показали, что пересаженные в миокард собаки мезенхимальные стволовые клетки человека сформировали между собой и с желудочковыми миоцитами так называемые щелевые контакты - канальные белки, переносящие электрический ток между сопряженными клетками (рис.4) [26]. Полученный пейсмекерный ток проявлял типичные для него свойства: активизировался при гиперполяризации клетки, отвечал на катехоламины и ацетилхолин и блокировался цезием [25].
Рис. 4. Микрофотография гистологического среза миокарда собаки, которой имплантировали человеческие стволовых клеток с экспрессированным геном HCN2 [26]. Белыми стрелками показаны щелевые контакты, образовавшиеся между стволовыми клетками, красными - между стволовыми клетками и кардиомиоцитами, фиолетовой стрелкой отмечено место пролиферации стволовых клеток (интеркалярный, или вставочный диск).
Итак, мезенхимальные стволовые клетки взрослого человека, судя по всему, можно использовать в качестве субстрата для формирования сино-атриального узла, что было подтверждено в экспериментах на собаках. Но прежде, чем дойдет очередь до человека, предстоит сделать еще очень многое. Например, проверить in situ чувствительность биологического водителя ритма к автономным нервным воздействиям, сравнить длительность функции созданного биологического пейсмекера и его эффективность с соответствующими параметрами электрокардиостимулятора, проверить на токсичность и тератогенность. Кроме того, выяснить, задержатся ли используемые генные конструкции и клетки именно там, куда их ввели, или мигрируют. Неизвестно также, останутся ли стволовые клетки после трансплантации дискретными и/или дифференцируются в другие клеточные типы, и не будут ли они отторгаться. И наконец, надо устранить главный недостаток биологических пейсмекеров, проявившийся как в экспериментах с использованием аденовирусных конструкций, так и стволовых клеток, несущих ген HCN2, - сократить интервал между остановкой синусового ритма и до возникновения идиовентрикулярного (в идеале он должен длиться одну-две секунды).
До тех пор, пока не удастся ответить на все эти вопросы, рано говорить о практическом применении биологических водителей ритма и отказываться от электронных пейсмекеров - главного достижения 20-го столетия в лечении заболеваний проводящей системы сердца. Тем не менее есть все основания надеяться, что не за горами то время, когда с помощью генной и клеточной терапии будут решаться многие проблемы в различных областях медицины, и только наше воображение может ограничить применение этих методик.
Работа выполнена при поддержке USPHS-NHLBI (проекты № HL-28958, HL-67101, HL-20559, GM-55263) и отмечена премией “Heritage”, учрежденной Американской ассоциацией сердца (American Heart Association).
Список литературы
1. Zivin A., Bardy G.H. Cardiac pacemakers // Foundations of Cardiac Arrhythmias / Eds. P.M.Spooner, M.R.Rosen. N.Y., 2001. P.571-598.
2. Hoffman B.F., Cranefield P.F. Electrophysiology of the Heart. N.Y., 1960.
3. DiFrancesco D. // J. Physiol. 1981. №314. P.377-393.
4. DiFrancesco D. // J. Physiol. 1982. №329. P.485-507.
5. Brown H.F., Kimura J., Noble D. // Proc. R. Soc. Lond. B. 1984. №222. P.329-347.
6. Hagiwara N., Irisawa H., Kameyama M. // J. Physiol (Lond). 1988. №395. P.233-253.
7. Hagiwara N., Irisawa H., Kasanuki H. // J. Physiol (Lond). 1992. №448. P.53-72.
8. Noma A., Irisawa H. // Jpn J. Physiol. 1975. №25. P.287-302.
9. Ono K., Ito H. // Am. J. Physiol. 1995. №269. P.H453-H462.
10. Li J., Qu J., Nathan R.D. // Am. J. Physiol. 1997. №273. P.H2481-H2489.
11. Edelberg J.M., Aird W.C., Rosenberg R.D. // J. Clin. Invest. 1998. №101. P.337-343.
12. Edelberg J.M., Huang D.T., Josephson M.E., Rosenberg R.D. // Heart. 2001. №86. P.559-562.
13. Miake J., Marbбn E., Nuss H.B. // Nature. 2002. №419. P.132-133.
14. Miake J., Marbбn E., Nuss H.B. // J. Clin. Invest. 2003. V.111. №10. P.1529-1536.
15. Silva J., Rudy Y. // Circ. Res. 2003. №92. P.261-263.
16. Santoro B., Liu D.T., Yao H. et al. // Cell. 1998. №93. P.1-20.
17. Ludwig A., Zong X., Jeglitsch M. et al. // Nature. 1998. №393. P.587-591.
18. Qu J., Barbuti A., Protas L. et al. // Circ. Res. 2001. №89. P.E8-E14.
19. Rosen M.R., Brink P.R., Cohen I.S. et al. // Cardiovasc. Res. 2004. V.64. №1. P.12-23.
20. Qu J., Plotnikov A.N., Danilo P.Jr. et al. // Circulation. 2003. №107. P.1106-1109.
21. Plotnikov A.N., Sosunov E.A., Qu J. et al. // Circulation. 2004. №109. P.506-512.
22. Gepstein L. // Circ. Res. 2002. №91. P.866-876.
23. Zhang Y.M., Hartzell C., Narlow M. et al. // Circulation. 2002. V.106. №10. P.1294-1299.
24. Liechty K.W., MacKenzie T.C., Shaaban A.F. et al. // Nat. Med. 2000. V.6. №11. P.1282-1286.
25. Potapova I., Plotnikov A., Lu Z. et al. // Circ. Res. 2004. V.94. №7. P.952-959.
26. Valiunas V., Doronin S., Valiuniene L. et al. // J. Physiol. 2004. V.555. №3. P.617-626.