Реферат на тему Введение в теорию многоэлектронного атома Элементы теории многоэлектронных атомов
Работа добавлена на сайт bukvasha.net: 2014-12-25Поможем написать учебную работу
Если у вас возникли сложности с курсовой, контрольной, дипломной, рефератом, отчетом по практике, научно-исследовательской и любой другой работой - мы готовы помочь.

Предоплата всего
от 25%

Подписываем
договор
Введение в теорию многоэлектронного атома
Водородоподобные орбитали
1. Атом H и водородоподобный ион. Возмущение потенциала и расщепление уровней АО. Правило Маделунга-Клечковского.АО водородоподобных ионов - это волновые функции возможных состояний единственного электрона в электростатическом поле. Потенциальная энергия кулоновского притяжения единственного электрона к ядру в систем СГС выражается функцией вида
Наш знаменитый физик-теоретик академик Владимир Александрович Фок показал, что симметрия атома H (и одноэлектронного водородоподобного иона) существенно выше, чем симметрия простой трёхмерной сферы, и назвал её симметрией "четырёхмерного шара".
Очень общее свойство квантово-механических систем таково, что, кратность вырождения энергетических уровней тем выше, чем выше симметрия системы, и, напротив, любое возмущение системы искажает её симметрию, вызывая расщепление вырожденных уровней.
Этот эффект исследуют с помощью модельных приёмов теории. Так понижение симметрии одноэлектронного водородоподобного иона можно искусственно смоделировать, искажая вид потенциала. Такой приём приводится в книге знаменитого Э. Ферми (см. "Конспект лекций по квантовой механике"). Искусственно искажая потенциал, прослеживают, как это влияет на уровни АО. Для этого в модельный потенциал вводится дополнительный параметр :
При ®0 получается предельное выражение вида
Последствия такого искажения потенциала хорошо знакомы даже начинающему химику.
Уровни АО в водородоподобном ионе зависят только от главного квантового числа n и характеризуются очень высокой кратностью вырождения. Иными словами энергия всех состояний с разными l но с одним и тем же n одна и та же, т.е. все АО принадлежат одному и тому же уровню. При возмущении потенциала такой уровень расщепляется, и из него возникают несколько новых уровней, которые зависят уже не только от общего главного, но и от побочного квантового числа.
Их часто ещё называют подуровнями, как бы подчёркивая, что у них общее главное квантовое число, и все они остаются внутри некоторого сравнительно узкого интервала значений.
Расщеплённые уровни АО многоэлектронного атома подчиняются правилу Клечковского-Маделунга: "Уровни АО многоэлектронного атома возрастают с увеличением суммы двух квантовых чисел n+l, а при равных значениях суммы n+l глубже лежит уровень с меньшим значением n (т.е. большим l)".
Последовательность энергетических уровней АО многоэлектронного атома подчиняется правилу Клечковского-Маделунга.
| n+l | N,l | АО | n+l | n,l | АО | n+l | n,l | АО | n+l | n,l | АО | n+l | n,l | АО | n+l | n,l | АO |
| 1 | 1,0 | 1s | 3 | 2,1 | 2p | 5 | 3,2 | 3d | 6 | 4,2 | 4d | 7 | 4,3 | 4f | 8 | 5,3 | 5f |
| 2 | 2,0 | 2s | 3,0 | 3s | 4,1 | 4p | 5,1 | 5p | 5,2 | 5d | 6,2 | 6d | |||||
| 4 | 3,1 | 3p | 5,0 | 5s | 6,0 | 6s | 6,1 | 6p | 7,1 | 7p | |||||||
| 4,0 | 4s | 7,0 | 7s | 8,0 | 8s |
Таблица и график справа воспроизводят последовательность уровней АО многоэлектронного атома:
1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f<5d<6p<7s<5f<6d<7p<8s
9.2. Водородоподобные орбитали. Многоэлектронный гамильтониан атомной оболочки. Межэлектронное отталкивание как экранирование ядра. Одноэлектронное приближение. Орбитали многоэлектронного атома.
2. Элементы теории многоэлектронных атомов
2.1. Многоэлектронный атом. Содержание. Электронный гамильтониан многоэлектронного атома. Отталкивание электронов, потенциальная энергия отталкивания и ее приближенное представление в виде функции экранирования ядра. Эффективный заряд ядра. Орбитали Слейтера. Одноэлектронный приближение в теории многоэлектронного атома. Атомные орбитали многоэлектронных атомов, уровни и последовательность заполнения. Правило Клечковского-Маделунга. Модификация формулы Бора. Спин электрона.Одноэлектронное приближение.
Полная энергия электронной оболочки многоэлектронного атома состоит из нескольких слагаемых, и отображающий её многоэлектронный гамильтониан атома также включает в себя несколько слагаемых. Это следующие операторы:
Оператор кинетической энергии каждого электрона, равный
T= - (1/2) Ñ2,()
Оператор потенциальной энергии притяжения к ядру каждого электрона, равный
U(ri) = - Ze2/r,()
Оператор потенциальной энергии притяжения каждого электрона к ядру, равный
Оператор потенциальной энергии отталкивания электрона от прочих электронов, равныйU(rij) = S-Ze2/rij,()
Оператор потенциальной энергии отталкивания электрона от прочих электронов, равныйU(rij) = S-Ze2/rij,()
Принципы заполнения атомно-орбитальных уровней и построение основных электронных конфигураций: 1) водородоподобие (одноэлектронное приближение в атоме), 2) минимум энергии, 3) принцип Паули, 4) максимальный суммарный спин (1-е правило Хунда). Примеры основных электронных конфигураций легких атомов. Возбужденные атомные конфигурации.
Схема приближенного представления энергии электронного отталкивания в виде энергии экранирования ядра.
Все двухэлектронные слагаемые отталкивания в гамильтониане оболочки атома образуют двумерный косоугольный массив. Их следует просуммировать и приближённо представить суммой, слагаемые которой распределены по отдельным частицам. В таком приближении многоэлектронный гамильтониан примет аддитивный вид. На этом основании можно ввести приближение независимых электронов-"одноэлектронное" приближение.
| Номера и координаты частиц | 1 | 2 | 3 | 4 | | i | j | z | |||
| | V1 | V12 | V13 | V14 | ... | V1i | V1j | V1z | |||
| | V2 | V23 | V24 | ... | ... | ... | V2z | ||||
| ... | ... | ... | ... | ... | ... | ... | ... | ... | |||
| | Vi | ... | ... | ... | ... | ... | Vij | Viz | |||
| ... | ... | ... | ... | ... | ... | ... | ... | ... | |||
| | Vj | Vji | ... | Vjz | |||||||
| ... | ... | ... | ... | ... | ... | ||||||
| | Vz-1 | ... | Vz-1,z | ||||||||
| | Vz | ... | ... | ... | ... | ... | ... | ||||

s(ri) - заряд экранирования (функция экранирования) отдельного электрона внутренними электронами, более близкими к ядру.
В этом случае потенциальная кулоновская энергия притяжения всех электронов к ядру дополняется эффективной потенциальной функцией экранирования ядра, и получается эффективное приближённое аддитивное выражение для всей кулоновской потенциальной энергии электронной оболочки
Микросостояния и атомные термы в приближении Рассела-Саундерса.
Этот раздел целесообразно рассмотреть на конкретных примерах.
Содержание. Электронная конфигурация. Микросостояния и их систематизация. Порядок учёта кулоновских взаимодействий и постадийная классификация дискретных электронных уровней и состояний атома (электронно-ядерное притяжение и орбитальные уровни, межэлектронное отталкивание и атомные термы Рассел-Саундерса, спин-спиновая корреляция и запрет Паули). Суммарные квантовые числа ML,MS,L,S. Атомное внутреннее квантовое число J. Термы нормальные и обращённые. Правила Хунда (1-е, 2-е и 3-е). Относительная шкала энергии атомных термов. Спектральные переходы и правила отбора. Атомные уровни в магнитном поле, эффект Зеемана (практикум).
Электронная конфигурация представляет собой исходное понятие. Оно определяется в нулевом приближении в оценке энергии. Далее постепенно учитываются всё более тонкие взаимодействия, и возникает более точная картина состояний и уровней многоэлектронного атома. Если атомный подуровень заселён неполностью, то возникает несколько различных микросостояний. Их характеристики непосредственно определяются комбинаторикой размещений электронов в системе спин-орбиталей.
Если n электронов заселяют g спин-орбиталей, то одно из формальных обозначений конфигурации (g,n). В её пределах число возможных микросостояний определяется согласно статистике Ферми: W(g,n) = g! / [n! (g - n) !].
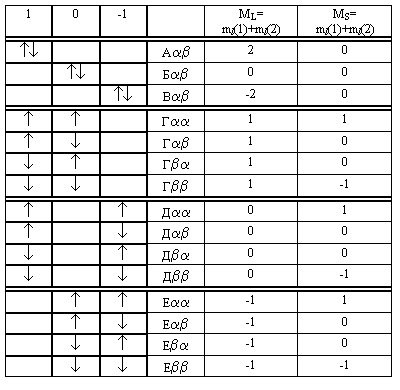
Пример 1: основная электронная конфигурация атома углерода C (1s22s22p2)
Конфигурация p2 (атомы IV группы элементов C, Si. .). W(6,2) = 6! / [2! (6 - 2) !] =15
Перечислим все возможные варианты орбитальных размещений и спиновых комбина-ций 2-х электронов на трёх АО:  | Орбитальные распределения двух электронов  | Возможно всего шесть размещений внутри p-АО без учёта спина Орбитальные распре-деления можно охарак-теризовать комбинаци-ями квантовых чисел частиц (m1, m2): (+1,+1) А (0, 0) Б (- 1, - 1) В (+1, 0) Г (+1, - 1) Д (0, - 1) Е |
| Способ 1 | SYMBOL 173 \f "Symbol" \s 12SYMBOL 173 \f "Symbol" \s 12 | SYMBOL 173 \f "Symbol" \s 12SYMBOL 175 \f "Symbol" \s 12Ї | SYMBOL 175 \f "Symbol" \s 12ЇSYMBOL 173 \f "Symbol" \s 12 | SYMBOL 175 \f "Symbol" \s 12ЇSYMBOL 175 \f "Symbol" \s 12Ї | Эти три способа |
| Способ 2 | (++) | (– +) | (–+) | (– –) | Описания |
| Способ 3 | SYMBOL 97 \f "Symbol" \s 12aSYMBOL 97 \f "Symbol" \s 12a | SYMBOL 97 \f "Symbol" \s 12aSYMBOL 98 \f "Symbol" \s 12b | SYMBOL 98 \f "Symbol" \s 12bSYMBOL 97 \f "Symbol" \s 12a | SYMBOL 98 \f "Symbol" \s 12bSYMBOL 98 \f "Symbol" \s 12b | Идентичны |
| Можно как-либо еще, а в итоге будет: | где MS(1,2) = mS(1) + mS(2) | ||||
| MS(1,2) | 1 | 0 | 0 | -1 | |
| MS(1,2) | +1 | 0 | –1 | |
| Микросостояния в рамке, выделенные на тёмном фоне, принципу Паули не удовлетворяют и должны быть исключены из дальнейшего анализа | A SYMBOL 97 \f "Symbol" \s 12SYMBOL 97 \f "Symbol" \s 12 | АSYMBOL 97 \f "Symbol" \s 12SYMBOL 98 \f "Symbol" \s 12 SYMBOL 186 \f "Symbol" \s 12 АSYMBOL 98 \f "Symbol" \s 12SYMBOL 97 \f "Symbol" \s 12 | АSYMBOL 98 \f "Symbol" \s 12SYMBOL 98 \f "Symbol" \s 12 | |
| A SYMBOL 97 \f "Symbol" \s 12SYMBOL 97 \f "Symbol" \s 12 | БSYMBOL 97 \f "Symbol" \s 12SYMBOL 98 \f "Symbol" \s 12 SYMBOL 186 \f "Symbol" \s 12 БSYMBOL 98 \f "Symbol" \s 12SYMBOL 97 \f "Symbol" \s 12 | A SYMBOL 98 \f "Symbol" \s 12SYMBOL 98 \f "Symbol" \s 12 | ||
| A SYMBOL 97 \f "Symbol" \s 12SYMBOL 97 \f "Symbol" \s 12 | ВSYMBOL 97 \f "Symbol" \s 12SYMBOL 98 \f "Symbol" \s 12 SYMBOL 186 \f "Symbol" \s 12 ВSYMBOL 98 \f "Symbol" \s 12SYMBOL 97 \f "Symbol" \s 12 | A SYMBOL 98 \f "Symbol" \s 12SYMBOL 98 \f "Symbol" \s 12 | ||
| ГSYMBOL 97 \f "Symbol" \s 12SYMBOL 97 \f "Symbol" \s 12 | ГSYMBOL 97 \f "Symbol" \s 12SYMBOL 98 \f "Symbol" \s 12 | ГSYMBOL 98 \f "Symbol" \s 12SYMBOL 97 \f "Symbol" \s 12 | ГSYMBOL 98 \f "Symbol" \s 12SYMBOL 98 \f "Symbol" \s 12 | |
| ДSYMBOL 97 \f "Symbol" \s 12SYMBOL 97 \f "Symbol" \s 12 | ДSYMBOL 97 \f "Symbol" \s 12SYMBOL 98 \f "Symbol" \s 12 | ДSYMBOL 98 \f "Symbol" \s 12SYMBOL 97 \f "Symbol" \s 12 | ДSYMBOL 98 \f "Symbol" \s 12SYMBOL 98 \f "Symbol" \s 12 | |
| ЕSYMBOL 97 \f "Symbol" \s 12SYMBOL 97 \f "Symbol" \s 12 | ЕSYMBOL 97 \f "Symbol" \s 12SYMBOL 98 \f "Symbol" \s 12 | ЕSYMBOL 98 \f "Symbol" \s 12SYMBOL 97 \f "Symbol" \s 12 | ЕSYMBOL 98 \f "Symbol" \s 12SYMBOL 98 \f "Symbol" \s 12 | |
Например:
|
 |
С помощью двойки чисел (ML, MS) можно частично охарактеризовать микросостояние оболочки, но это ещё не исчерпывающая характеристика.