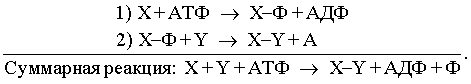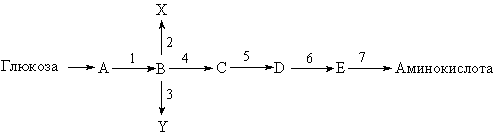Доклад на тему Метаболизм
Работа добавлена на сайт bukvasha.net: 2015-06-29Поможем написать учебную работу
Если у вас возникли сложности с курсовой, контрольной, дипломной, рефератом, отчетом по практике, научно-исследовательской и любой другой работой - мы готовы помочь.

Предоплата всего

Подписываем
Метаболизм, или обмен веществ, химические превращения, протекающие от момента поступления питательных веществ в живой организм до момента, когда конечные продукты этих превращений выделяются во внешнюю среду. К метаболизму относятся все реакции, в результате которых строятся структурные элементы клеток и тканей, и процессы, в которых из содержащихся в клетках веществ извлекается энергия. Иногда для удобства рассматривают по отдельности две стороны метаболизма – анаболизм и катаболизм, т.е. процессы созидания органических веществ и процессы их разрушения. Анаболические процессы обычно связаны с затратой энергии и приводят к образованию сложных молекул из более простых, катаболические же сопровождаются высвобождением энергии и заканчиваются образованием таких конечных продуктов (отходов) метаболизма, как мочевина, диоксид углерода, аммиак и вода.
Термин «обмен веществ» вошел в повседневную жизнь с тех пор, как врачи стали связывать избыточный или недостаточный вес, чрезмерную нервозность или, наоборот, вялость больного с повышенным или пониженным обменом. Для суждения об интенсивности метаболизма ставят тест на «основной обмен». Основной обмен – это показатель способности организма вырабатывать энергию. Тест проводят натощак в состоянии покоя; измеряют поглощение кислорода (О2) и выделение диоксида углерода (СО2). Сопоставляя эти величины, определяют, насколько полно организм использует («сжигает») питательные вещества. На интенсивность метаболизма влияют гормоны щитовидной железы, поэтому врачи при диагностике заболеваний, связанных с нарушениями обмена, в последнее время все чаще измеряют уровень этих гормонов в крови.
Методы исследования. При изучении метаболизма какого-нибудь одного из питательных веществ прослеживают все его превращения от той формы, в какой оно поступает в организм, до конечных продуктов, выводимых из организма. В таких исследованиях применяется крайне разнообразный набор биохимических методов.
Использование интактных животных или органов. Животному вводят изучаемое соединение, а затем в его моче и экскрементах определяют возможные продукты превращений (метаболиты) этого вещества. Более определенную информацию можно получить, исследуя метаболизм определенного органа, например печени или мозга. В этих случаях вещество вводят в соответствующий кровеносный сосуд, а метаболиты определяют в крови, оттекающей от данного органа.
Поскольку такого рода процедуры сопряжены с большими трудностями, часто для исследования используют тонкие срезы органов. Их инкубируют при комнатной температуре или при температуре тела в растворах с добавкой того вещества, метаболизм которого изучают. Клетки в таких препаратах не повреждены, и так как срезы очень тонкие, вещество легко проникает в клетки и легко выходит из них. Иногда затруднения возникают из-за слишком медленного прохождения вещества сквозь клеточные мембраны. В этих случаях ткани измельчают, чтобы разрушить мембраны, и с изучаемым веществом инкубируют клеточную кашицу. Именно в таких опытах было показано, что все живые клетки окисляют глюкозу до СО2 и воды и что только ткань печени способна синтезировать мочевину.
Использование клеток. Даже клетки представляют собой очень сложно организованные системы. В них имеется ядро, а в окружающей его цитоплазме находятся более мелкие тельца, т.н. органеллы, различных размеров и консистенции. С помощью соответствующей методики ткань можно «гомогенизировать», а затем подвергнуть дифференциальному центрифугированию (разделению) и получить препараты, содержащие только митохондрии, только микросомы или прозрачную жидкость – цитоплазму. Эти препараты можно по отдельности инкубировать с тем соединением, метаболизм которого изучается, и таким путем установить, какие именно субклеточные структуры участвуют в его последовательных превращениях. Известны случаи, когда начальная реакция протекает в цитоплазме, ее продукт подвергается превращению в микросомах, а продукт этого превращения вступает в новую реакцию уже в митохондриях. Инкубация изучаемого вещества с живыми клетками или с гомогенатом ткани обычно не выявляет отдельные этапы его метаболизма, и только последовательные эксперименты, в которых для инкубации используются те или иные субклеточные структуры, позволяют понять всю цепочку событий.
Использование радиоактивных изотопов. Для изучения метаболизма какого-либо вещества необходимы: 1) соответствующие аналитические методы для определения этого вещества и его метаболитов; и 2) методы, позволяющие отличать добавленное вещество от того же вещества, уже присутствующего в данном биологическом препарате. Эти требования служили главным препятствием при изучении метаболизма до тех пор, пока не были открыты радиоактивные изотопы элементов и в первую очередь радиоактивный углерод 14C. С появлением соединений, «меченных» 14C, а также приборов для измерения слабой радиоактивности эти трудности были преодолены. Если к биологическому препарату, например к суспензии митохондрий, добавляют меченную 14C жирную кислоту, то никаких специальных анализов для определения продуктов ее превращений не требуется; чтобы оценить скорость ее использования, достаточно просто измерять радиоактивность последовательно получаемых митохондриальных фракций. Эта же методика позволяет легко отличать молекулы радиоактивной жирной кислоты, введенной экспериментатором, от молекул жирной кислоты, уже присутствовавших в митохондриях к началу эксперимента.
Хроматография и электрофорез. В дополнение к вышеупомянутым требованиям биохимику необходимы и методы, позволяющие разделять смеси, состоящие из малых количеств органических веществ. Важнейший из них – хроматография, в основе которой лежит феномен адсорбции. Разделение компонентов смеси проводят при этом либо на бумаге, либо путем адсорбции на сорбенте, которым заполняют колонки (длинные стеклянные трубки), с последующей постепенной элюцией (вымыванием) каждого из компонентов.
Разделение методом электрофореза зависит от знака и числа зарядов ионизированных молекул. Электрофорез проводят на бумаге или на каком-нибудь инертном (неактивном) носителе, таком, как крахмал, целлюлоза или каучук.
Высокочувствительный и эффективный метод разделения – газовая хроматография. Им пользуются в тех случаях, когда подлежащие разделению вещества находятся в газообразном состоянии или могут быть в него переведены.
Выделение ферментов. Последнее место в описываемом ряду – животное, орган, тканевой срез, гомогенат и фракция клеточных органелл – занимает фермент, способный катализировать определенную химическую реакцию. Выделение ферментов в очищенном виде – важный раздел в изучении метаболизма.
Сочетание перечисленных методов позволило проследить главные метаболические пути у большей части организмов (в том числе у человека), установить, где именно эти различные процессы протекают, и выяснить последовательные этапы главных метаболических путей. К настоящему времени известны тысячи отдельных биохимических реакций, изучены участвующие в них ферменты.
Клеточный метаболизм. Живая клетка – это высокоорганизованная система. В ней имеются различные структуры, а также ферменты, способные их разрушить. Содержатся в ней и крупные макромолекулы, которые могут распадаться на более мелкие компоненты в результате гидролиза (расщепления под действием воды). В клетке обычно много калия и очень мало натрия, хотя клетка существует в среде, где натрия много, а калия относительно мало, и клеточная мембрана легко проницаема для обоих ионов. Следовательно, клетка – это химическая система, весьма далекая от равновесия. Равновесие наступает только в процессе посмертного автолиза (самопереваривания под действием собственных ферментов).
Потребность в энергии. Чтобы удержать систему в состоянии, далеком от химического равновесия, требуется производить работу, а для этого необходима энергия. Получение этой энергии и выполнение этой работы – непременное условие для того, чтобы клетка оставалась в своем стационарном (нормальном) состоянии, далеком от равновесия. Одновременно в ней выполняется и иная работа, связанная со взаимодействием со средой, например: в мышечных клетках – сокращение; в нервных клетках – проведение нервного импульса; в клетках почек – образование мочи, значительно отличающейся по своему составу от плазмы крови; в специализированных клетках желудочно-кишечного тракта – синтез и выделение пищеварительных ферментов; в клетках эндокринных желез – секреция гормонов; в клетках светляков – свечение; в клетках некоторых рыб – генерирование электрических разрядов и т.д.
Источники энергии. В любом из перечисленных выше примеров непосредственным источником энергии, которую клетка использует для производства работы, служит энергия, заключенная в структуре аденозинтрифосфата (АТФ). В силу особенностей своей структуры это соединение богато энергией, и разрыв связей между его фосфатными группами может происходить таким образом, что высвобождающаяся энергия используется для производства работы. Однако энергия не может стать доступной для клетки при простом гидролитическом разрыве фосфатных связей АТФ: в этом случае она расходуется впустую, выделяясь в виде тепла. Процесс должен состоять из двух последовательных этапов, в каждом из которых участвует промежуточный продукт, обозначенный здесь X–Ф (в приведенных уравнениях X и Y означают два разных органических вещества; Ф – фосфат; АДФ – аденозиндифосфат):
Поскольку практически для любого проявления жизнедеятельности клеток необходим АТФ, неудивительно, что метаболическая активность живых клеток направлена в первую очередь на синтез АТФ. Этой цели служат различные сложные последовательности реакций, в которых используется потенциальная химическая энергия, заключенная в молекулах углеводов и жиров (липидов).
Метаболизм углеводов и липидов
Синтез АТФ. Анаэробный (без участия кислорода). Главная роль углеводов и липидов в клеточном метаболизме состоит в том, что их расщепление на более простые соединения обеспечивает синтез АТФ. Несомненно, что те же процессы протекали и в первых, самых примитивных клетках. Однако в атмосфере, лишенной кислорода, полное окисление углеводов и жиров до CO2 было невозможно. У этих примитивных клеток имелись все же механизмы, с помощью которых перестройка структуры молекулы глюкозы обеспечивала синтез небольших количеств АТФ. Речь идет о процессах, которые у микроорганизмов называют брожением. Лучше всего изучено сбраживание глюкозы до этилового спирта и CO2 у дрожжей.
В ходе 11 последовательных реакций, необходимых для того, чтобы завершилось это превращение, образуется ряд промежуточных продуктов, представляющих собой эфиры фосфорной кислоты (фосфаты). Их фосфатная группа переносится на аденозиндифосфат (АДФ) с образованием АТФ. Чистый выход АТФ составляет 2 молекулы АТФ на каждую молекулу глюкозы, расщепленную в процессе брожения. Аналогичные процессы происходят во всех живых клетках; поскольку они поставляют необходимую для жизнедеятельности энергию, их иногда (не вполне корректно) называют анаэробным дыханием клеток.
У млекопитающих, в том числе у человека, такой процесс называется гликолизом и его конечным продуктом является молочная кислота, а не спирт и CO2. Вся последовательность реакций гликолиза, за исключением двух последних этапов, полностью идентична процессу, протекающему в дрожжевых клетках.
Аэробный (с использованием кислорода). С появлением в атмосфере кислорода, источником которого послужил, очевидно, фотосинтез растений, в ходе эволюции развился механизм, обеспечивающий полное окисление глюкозы до CO2 и воды, – аэробный процесс, в котором чистый выход АТФ составляет 38 молекул АТФ на каждую окисленную молекулу глюкозы. Этот процесс потребления клетками кислорода для образования богатых энергией соединений известен как клеточное дыхание (аэробное). В отличие от анаэробного процесса, осуществляемого ферментами цитоплазмы, окислительные процессы протекают в митохондриях. В митохондриях пировиноградная кислота – промежуточный продукт, образовавшийся в анаэробной фазе – окисляется до СО2 в шести последовательных реакциях, в каждой из которых пара электронов переносится на общий акцептор – кофермент никотинамидадениндинуклеотид (НАД). Эту последовательность реакций называют циклом трикарбоновых кислот, циклом лимонной кислоты или циклом Кребса. Из каждой молекулы глюкозы образуется 2 молекулы пировиноградной кислоты; 12 пар электронов отщепляется от молекулы глюкозы в ходе ее окисления, описываемого уравнением:
Перенос электронов. В каждой митохондрии имеется механизм, посредством которого восстановленный НАД (НАДН, где Н – водород), образовавшийся в цикле трикарбоновых кислот, передает свою пару электронов кислороду. Перенос, однако, не происходит напрямую. Электроны как бы передаются «из рук в руки» и, лишь пройдя цепь переносчиков, присоединяются к кислороду. Эта «цепь переноса электронов» состоит из следующих компонентов:
НАДНН Флавинадениндинклеотид Кофермент Q
Цитохром b Цитохром c Цитохром a O2
Все компоненты этой системы, находящиеся в митохондриях, фиксированы в пространстве и сцеплены друг с другом. Такое их состояние облегчает перенос электронов.
В состав НАД входит никотиновая кислота (витамин ниацин), а в состав флавинадениндинуклеотида – рибофлавин (витамин B2). Кофермент Q представляет собой высокомолекулярный хинон, синтезируемый в печени, а цитохромы – это три разных белка, каждый из которых, подобно гемоглобину, содержит гемогруппу.
В цепи переноса электронов на каждую пару электронов, перенесенную от НАДН на O2, синтезируется 3 молекулы АТФ. Поскольку от каждой молекулы глюкозы отщепляются и передаются молекулам НАД 12 пар электронов, в общей сложности на каждую молекулу глюкозы образуется 312 = 36 молекул АТФ. Этот процесс образования АТФ в ходе окисления называется окислительным фосфорилированием.
Липиды как источник энергии. Жирные кислоты могут использоваться в качестве источника энергии приблизительно так же, как и углеводы. Окисление жирных кислот протекает путем последовательного отщепления от молекулы жирной кислоты двууглеродного фрагмента с образованием ацетилкофермента A (ацетил-КоА) и одновременной передачей двух пар электронов в цепь переноса электронов. Образовавшийся ацетил-КоА – нормальный компонент цикла трикарбоновых кислот, и в дальнейшем его судьба не отличается от судьбы ацетил-КоА, поставляемого углеводным обменом. Таким образом, механизмы синтеза АТФ при окислении как жирных кислот, так и метаболитов глюкозы практически одинаковы.
Если организм животного получает энергию почти целиком за счет одного только окисления жирных кислот, а это бывает, например, при голодании или при сахарном диабете, то скорость образования ацетил-КоА превышает скорость его окисления в цикле трикарбоновых кислот. В этом случае лишние молекулы ацетил-КоА реагируют друг с другом, в результате чего образуются в конечном счете ацетоуксусная и -гидроксимасляная кислоты. Их накопление является причиной патологического состояния, т.н. кетоза (одного из видов ацидоза), который при тяжелом диабете может вызвать кому и смерть.
Запасание энергии. Животные питаются нерегулярно, и их организму нужно как-то запасать заключенную в пище энергию, источником которой являются поглощенные животным углеводы и жиры. Жирные кислоты могут запасаться в виде нейтральных жиров либо в печени, либо в жировой ткани. Углеводы, поступая в большом количестве, в желудочно-кишечном тракте гидролизуются до глюкозы или иных сахаров, которые затем в печени превращаются в ту же глюкозу. Здесь из глюкозы синтезируется гигантский полимер гликоген путем присоединения друг к другу остатков глюкозы с отщеплением молекул воды (число остатков глюкозы в молекулах гликогена доходит до 30 000). Когда возникает потребность в энергии, гликоген вновь распадается до глюкозы в реакции, продуктом которой является глюкозофосфат. Этот глюкозофосфат направляется на путь гликолиза – процесса, составляющего часть пути окисления глюкозы. В печени глюкозофосфат может также подвергнуться гидролизу, и образующаяся глюкоза поступает в кровоток и доставляется кровью к клеткам в разных частях тела.
Синтез липидов из углеводов. Если количество углеводов, поглощенных с пищей за один прием, больше того, какое может быть запасено в виде гликогена, то избыток углеводов превращается в жиры. Начальная последовательность реакций совпадает при этом с обычным окислительным путем, т.е. сначала из глюкозы образуется ацетил-КоА, но далее этот ацетил-КоА используется в цитоплазме клетки для синтеза длинноцепочечных жирных кислот. Процесс синтеза можно описать как обращение обычного процесса окисления жирных клеток. Затем жирные кислоты запасаются в виде нейтральных жиров (триглицеридов), отлагающихся в разных частях тела. Когда требуется энергия, нейтральные жиры подвергаются гидролизу и жирные кислоты поступают в кровь. Здесь они адсорбируются молекулами плазменных белков (альбуминов и глобулинов) и затем поглощаются клетками самых разных типов. Механизмов, способных осуществлять синтез глюкозы из жирных кислот, у животных нет, но у растений такие механизмы имеются.
Метаболизм липидов. Липиды попадают в организм главным образом в форме триглицеридов жирных кислот. В кишечнике под действием ферментов поджелудочной железы они подвергаются гидролизу, продукты которого всасываются клетками стенки кишечника. Здесь из них вновь синтезируются нейтральные жиры, которые через лимфатическую систему поступают в кровь и либо транспортируются в печень, либо отлагаются в жировой ткани. Выше уже указывалось, что жирные кислоты могут также синтезироваться заново из углеводных предшественников. Следует отметить, что, хотя в клетках млекопитающих может происходить включение одной двойной связи в молекулы длинноцепочечных жирных кислот (между С–9 и С–10), включать вторую и третью двойную связь эти клетки неспособны. Поскольку жирные кислоты с двумя и тремя двойными связями играют важную роль в метаболизме млекопитающих, они в сущности являются витаминами. Поэтому линолевую (C18:2) и линоленовую (C18:3) кислоты называют незаменимыми жирными кислотами. В то же время в клетках млекопитающих в линоленовую кислоту может включаться четвертая двойная связь и путем удлинения углеродной цепи может образоваться арахидоновая кислота (C20:4), также необходимый участник метаболических процессов.
В процессе синтеза липидов остатки жирных кислот, связанные с коферментом А (ацил-КоА), переносятся на глицерофосфат – эфир фосфорной кислоты и глицерина. В результате образуется фосфатидная кислота – соединение, в котором одна гидроксильная группа глицерина этерифицирована фосфорной кислотой, а две группы – жирными кислотами. При образовании нейтральных жиров фосфорная кислота удаляется путем гидролиза, и ее место занимает третья жирная кислота в результате реакции с ацил-КоА. Кофермент А образуется из пантотеновой кислоты (одного из витаминов). В его молекуле имеется сульфгидрильная (– SH) группа, способная реагировать с кислотами с образованием тиоэфиров. При образовании фосфолипидов фосфатидная кислота реагирует непосредственно с активированным производным одного из азотистых оснований, таких, как холин, этаноламин или серин.
За исключением витамина D, все встречающиеся в организме животных стероиды (производные сложных спиртов) легко синтезируются самим организмом. Сюда относятся холестерин (холестерол), желчные кислоты, мужские и женские половые гормоны и гормоны надпочечников. В каждом случае исходным материалом для синтеза служит ацетил-КоА: из ацетильных групп путем многократно повторяющейся конденсации строится углеродный скелет синтезируемого соединения.
Метаболизм белков
Синтез аминокислот. Растения и большинство микроорганизмов могут жить и расти в среде, в которой для их питания имеются только минеральные вещества, диоксид углерода и вода. Это значит, что все обнаруживаемые в них органические вещества эти организмы синтезируют сами. Встречающиеся во всех живых клетках белки построены из 21 вида аминокислот, соединенных в различной последовательности. Аминокислоты синтезируются живыми организмами. В каждом случае ряд химических реакций приводит к образованию -кетокислоты. Одна такая -кетокислота, а именно -кетоглутаровая (обычный компонент цикла трикарбоновых кислот), участвует в связывании азота по следующему уравнению:
-Кетоглутаровая кислота + NH3 + НАДН
Глутаминовая кислота + НАД.
Азот глутаминовой кислоты может быть затем передан любой из других -кетокислот с образованием соответствующей аминокислоты.
Организм человека и большинства других животных сохранил способность синтезировать все аминокислоты за исключением девяти т.н. незаменимых аминокислот. Поскольку кетокислоты, соответствующие этим девяти, не синтезируются, незаменимые аминокислоты должны поступать с пищей.
Синтез белков. Аминокислоты нужны для биосинтеза белка. Процесс биосинтеза протекает обычно следующим образом. В цитоплазме клетки каждая аминокислота «активируется» в реакции с АТФ, а затем присоединяется к концевой группе молекулы рибонуклеиновой кислоты, специфичной именно для данной аминокислоты. Эта сложная молекула связывается с небольшим тельцем, т.н. рибосомой, в положении, определяемом более длинной молекулой рибонуклеиновой кислоты, прикрепленной к рибосоме. После того как все эти сложные молекулы соответствующим образом выстроились, связи между исходной аминокислотой и рибонуклеиновой кислотой разрываются и возникают связи между соседними аминокислотами – синтезируется специфичный белок. Процесс биосинтеза поставляет белки не только для роста организма или для секреции в среду. Все белки живых клеток со временем претерпевают распад до составляющих их аминокислот, и для поддержания жизни клетки должны синтезироваться вновь.
Синтез других азотсодержащих соединений. В организме млекопитающих аминокислоты используются не только для биосинтеза белков, но и как исходный материал для синтеза многих азотсодержащих соединений. Аминокислота тирозин является предшественником гормонов адреналина и норадреналина. Простейшая аминокислота глицин служит исходным материалом для биосинтеза пуринов, входящих в состав нуклеиновых кислот, и порфиринов, входящих в состав цитохромов и гемоглобина. Аспарагиновая кислота – предшественник пиримидинов нуклеиновых кислот. Метильная группа метионина передается ряду других соединений в ходе биосинтеза креатина, холина и саркозина. При биосинтезе креатина от одного соединения к другому передается также и гуанидиновая группировка аргинина. Триптофан служит предшественником никотиновой кислоты, а из валина в растениях синтезируется такой витамин, как пантотеновая кислота. Все это лишь отдельные примеры использования аминокислот в процессах биосинтеза.
Азот, поглощаемый микроорганизмами и высшими растениями в виде иона аммония, расходуется почти целиком на образование аминокислот, из которых затем синтезируются многие азотсодержащие соединения живых клеток. Избыточных количеств азота ни растения, ни микроорганизмы не поглощают. В отличие от них, у животных количество поглощенного азота зависит от содержащихся в пище белков. Весь азот, поступивший в организм в виде аминокислот и не израсходованный в процессах биосинтеза, довольно быстро выводится из организма с мочой. Происходит это следующим образом. В печени неиспользованные аминокислоты передают свой азот -кетоглутаровой кислоте с образованием глутаминовой кислоты, которая дезаминируется, высвобождая аммиак. Далее азот аммиака может либо на время запасаться путем синтеза глутамина, либо сразу же использоваться для синтеза мочевины, протекающего в печени.
У глутамина есть и другая роль. Он может подвергаться гидролизу в почках с высвобождением аммиака, который поступает в мочу в обмен на ионы натрия. Этот процесс крайне важен как средство поддержания кислотно-щелочного равновесия в организме животного. Почти весь аммиак, происходящий из аминокислот и, возможно, из других источников, превращается в печени в мочевину, так что свободного аммиака в крови обычно почти нет. Однако при некоторых условиях довольно значительные количества аммиака содержит моча. Этот аммиак образуется в почках из глутамина и переходит в мочу в обмен на ионы натрия, которые таким образом реадсорбируются и задерживаются в организме. Этот процесс усиливается при развитии ацидоза – состояния, при котором организм нуждается в дополнительных количествах катионов натрия для связывания избытка ионов бикарбоната в крови.
Избыточные количества пиримидинов тоже распадаются в печени через ряд реакций, в которых высвобождается аммиак. Что касается пуринов, то их избыток подвергается окислению с образованием мочевой кислоты, выделяющейся с мочой у человека и других приматов, но не у остальных млекопитающих. У птиц отсутствует механизм синтеза мочевины, и именно мочевая кислота, а не мочевина, является у них конечным продуктом обмена всех азотсодержащих соединений.
Общие представления о метаболизме органических веществ
Можно сформулировать некоторые общие понятия, или «правила», касающиеся метаболизма. Приведенные ниже несколько главных «правил» позволяют лучше понять, как протекает и регулируется метаболизм.
1. Метаболические пути необратимы. Распад никогда не идет по пути, который являлся бы простым обращением реакций синтеза. В нем участвуют другие ферменты и другие промежуточные продукты. Нередко противоположно направленные процессы протекают в разных отсеках клетки. Так, жирные кислоты синтезируются в цитоплазме при участии одного набора ферментов, а окисляются в митохондриях при участии совсем другого набора.
2. Ферментов в живых клетках достаточно для того, чтобы все известные метаболические реакции могли протекать гораздо быстрее, чем это обычно наблюдается в организме. Следовательно, в клетках существуют какие-то регуляторные механизмы. Открыты разные типы таких механизмов.
а) Фактором, ограничивающим скорость метаболических превращений данного вещества, может быть поступление этого вещества в клетку; именно на этот процесс в таком случае и направлена регуляция. Роль инсулина, например, связана с тем, что он, по-видимому, облегчает проникновение глюкозы во все клетки, глюкоза же подвергается превращениям с той скоростью, с какой она поступает. Сходным образом проникновение железа и кальция из кишечника в кровь зависит от процессов, скорость которых регулируется.
б) Вещества далеко не всегда могут свободно переходить из одного клеточного отсека в другой; есть данные, что внутриклеточный перенос регулируется некоторыми стероидными гормонами.
в) Выявлено два типа сервомеханизмов «отрицательной обратной связи».
У бактерий были обнаружены примеры того, что присутствие продукта какой-нибудь последовательности реакций, например аминокислоты, подавляет биосинтез одного из ферментов, необходимых для образования этой аминокислоты.
В каждом случае фермент, биосинтез которого оказывается затронутым, был ответствен за первый «определяющий» этап (на схеме реакция 4) метаболического пути, ведущего к синтезу данной аминокислоты.
Второй механизм хорошо изучен у млекопитающих. Это простое ингибирование конечным продуктом (в нашем случае – аминокислотой) фермента, ответственного за первый «определяющий» этап метаболического пути.
Еще один тип регулирования посредством обратной связи действует в тех случаях, когда окисление промежуточных продуктов цикла трикарбоновых кислот сопряжено с образованием АТФ из АДФ и фосфата в процессе окислительного фосфорилирования. Если весь имеющийся в клетке запас фосфата и (или) АДФ уже исчерпан, то окисление приостанавливается и может возобновиться лишь после того, как этот запас вновь станет достаточным. Таким образом, окисление, смысл которого в том, чтобы поставлять полезную энергию в форме АТФ, происходит только тогда, когда возможен синтез АТФ.
3. В биосинтетических процессах участвует сравнительно небольшое число строительных блоков, каждый из которых используется для синтеза многих соединений. Среди них можно назвать ацетилкофермент А, глицерофосфат, глицин, карбамилфосфат, поставляющий карбамильную (H2N–CO–) группу, производные фолиевой кислоты, служащие источником гидроксиметильной и формильной групп, S-аденозилметионин – источник метильных групп, глутаминовую и аспарагиновую кислоты, поставляющие аминогруппы, и наконец, глутамин – источник амидных групп. Из этого относительно небольшого числа компонентов строятся все те разнообразные соединения, которые мы находим в живых организмах.
4. Простые органические соединения редко участвуют в метаболических реакциях непосредственно. Обычно они должны быть сначала «активированы» путем присоединения к одному из ряда соединений, универсально используемых в метаболизме. Глюкоза, например, может подвергнуться окислению лишь после того, как она будет этерифицирована фосфорной кислотой, для прочих же своих превращений она должна быть этерифицирована уридиндифосфатом. Жирные кислоты не могут быть вовлечены в метаболические превращения прежде, чем они образуют эфиры с коферментом А. Каждый из этих активаторов либо родствен одному из нуклеотидов, входящих в состав рибонуклеиновой кислоты, либо образуется из какого-нибудь витамина. Легко понять в связи с этим, почему витамины требуются в таких небольших количествах. Они расходуются на образование «коферментов», а каждая молекула кофермента на протяжении жизни организма используется многократно, в отличие от основных питательных веществ (например, глюкозы), каждая молекула которых используется только один раз.
В заключение следует сказать, что термин «метаболизм», означавший ранее нечто не более сложное, чем просто использование углеводов и жиров в организме, теперь применяется для обозначения тысяч ферментативных реакций, вся совокупность которых может быть представлена как огромная сеть метаболических путей, многократно пересекающихся (из-за наличия общих промежуточных продуктов) и управляемых очень тонкими регуляторными механизмами.
Метаболизм минеральных веществ
Относительное содержание. Различные элементы, встречающиеся в живых организмах, перечислены ниже в убывающем порядке в зависимости от их относительного содержания: 1) кислород, углерод, водород и азот; 2) кальций, фосфор, калий и сера; 3) натрий, хлор, магний и железо; 4) марганец, медь, молибден, селен, йод и цинк; 5) алюминий, фтор, кремний и литий; 6) бром, мышьяк, свинец и, возможно, некоторые другие.
Кислород, углерод, водород и азот – это те элементы, из которых построены мягкие ткани тела. Они входят в состав таких соединений, как углеводы, липиды, белки, вода, диоксид углерода и аммиак. Элементы, перечисленные в пп. 2 и 3, находятся в организме обычно в виде одного или нескольких неорганических соединений, а элементы пп. 4, 5 и 6 присутствуют только в следовых количествах и потому их называют микроэлементами.
Распределение в организме. Кальций. Кальций присутствует главным образом в костной ткани и в зубах, преимущественно в виде фосфата и в небольших количествах в виде карбоната и фторида. Поступающий с пищей кальций всасывается в основном в верхних отделах кишечника, имеющих слабокислую реакцию. Этому всасыванию (у человека здесь всасывается всего 20–30% кальция пищи) способствует витамин D. Под действием витамина D клетки кишечника вырабатывают особый белок, который связывает кальций и облегчает его перенос через стенку кишечника в кровь. На всасывание влияет также присутствие некоторых других веществ, в особенности фосфата и оксалата, которые в малых количествах способствуют всасыванию, а в больших, наоборот, подавляют его.
В крови около половины кальция связано с белком, остальное составляют ионы кальция. Соотношение ионизированной и неионизированной форм зависит от общей концентрации кальция в крови, а также от содержания белка и фосфата и концентрации водородных ионов (рН крови). Доля неионизированного кальция, на которую влияет уровень белка, позволяет косвенным образом судить о качестве питания и об эффективности работы печени, в которой идет синтез плазменных белков.
На количество ионизированного кальция влияют, с одной стороны, витамин D и факторы, воздействующие на всасывание, а с другой – паратиреоидный гормон и, возможно, также витамин D, поскольку оба эти вещества регулируют как скорость отложения кальция в костной ткани, так и его мобилизацию, т.е. вымывание из костей. Избыток паратиреоидного гормона стимулирует выход кальция из костной ткани, что приводит к повышению его концентрации в плазме. Изменяя скорости всасывания и экскреции кальция и фосфата, а также скорости образования костной ткани и ее разрушения, эти механизмы строго контролируют концентрацию кальция и фосфата в сыворотке крови. Ионы кальция играют регулирующую роль во многих физиологических процессах, в том числе в нервных реакциях, мышечном сокращении, свертывании крови. Выведение кальция из организма происходит в норме в основном (на 2/3) через желчь и кишечник и в меньшей степени (1/3) – через почки.
Фосфор. Метаболизм фосфора – одного из главных компонентов костной ткани и зубов – во многом зависит от тех же факторов, что и метаболизм кальция. Фосфор в виде фосфата присутствует в организме также в сотнях различных физиологически важных органических эфиров. Паратиреоидный гормон стимулирует выведение фосфора с мочой и выход его из костной ткани; тем самым он регулирует концентрацию фосфора в плазме крови.
Натрий. Натрий – главный катион внеклеточной жидкости – вместе с белком, хлоридом и бикарбонатом играет важнейшую роль в регулировании осмотического давления и pH (концентрации водородных ионов) крови. В клетках, напротив, содержится очень мало натрия, так как они обладают механизмом для выведения ионов натрия и удержания ионов калия. Весь натрий, превышающий потребности организма, очень быстро выводится через почки.
Поскольку во всех процессах выделения натрий теряется, он должен постоянно поступать в организм с пищей. При ацидозе, когда необходимо, чтобы из организма выводились большие количества анионов (например, хлорида или ацетоацетата), почки предотвращают чрезмерную потерю натрия благодаря образованию аммиака из глутамина. Выведение натрия через почки регулируется гормоном коры надпочечников альдостероном. Под действием этого гормона в кровь возвращается достаточно натрия для поддержания нормального осмотического давления и нормального объема внеклеточной жидкости.
Суточная потребность в хлористом натрии составляет 5–10 г. Эта величина возрастает при поглощении больших количеств жидкости, когда усиливается потоотделение и выделяется больше мочи.
Калий. В отличие от натрия, калий содержится в клетках в больших количествах, но во внеклеточной жидкости его мало. Главная функция калия – регулирование внутриклеточного осмотического давления и поддержание кислотно-щелочного равновесия. Он также играет важную роль в проведении нервного импульса и во многих ферментных системах, в том числе и в тех, которые участвуют в мышечном сокращении. Калий широко распространен в природе, и его много в любой пище, так что спонтанно калиевая недостаточность возникнуть не может. В плазме концентрация калия регулируется альдостероном, стимулирующим его экскрецию с мочой.
Сера. С пищей сера поступает в организм главным образом в составе двух аминокислот – цистина и метионина. На конечных этапах метаболизма этих аминокислот сера высвобождается и в результате окисления переводится в неорганическую форму. В составе цистина и метионина сера присутствует в структурных белках. Важную роль играет также сульфгидрильная (–SH) группа цистеина, от которой зависит активность многих ферментов.
Большая часть серы выводится с мочой в виде сульфата. Небольшое количество экскретируемого сульфата обычно связано с органическими соединениями типа фенолов.
Магний. Метаболизм магния сходен с метаболизмом кальция, и в виде комплекса с фосфатом этот элемент тоже входит в состав костной ткани. Магний присутствует во всех живых клетках, где он функционирует как необходимый компонент многих ферментных систем; эта его роль была убедительно продемонстрирована на примере углеводного обмена в мышцах. Магний, как и калий, широко распространен, и вероятность возникновения его недостаточности очень мала.
Железо. Железо входит в состав гемоглобина и других гемопротеинов, а именно миоглобина (мышечного гемоглобина), цитохромов (дыхательных ферментов) и каталазы, а также в состав некоторых ферментов, не содержащих гемогруппы. Всасывается железо в верхних отделах кишечника, причем это единственный элемент, всасывающийся только тогда, когда его запас в организме полностью исчерпан. В плазме железо транспортируется в соединении с белком (трансферрином). Через почки железо не выводится; избыток его накапливается в печени в соединении с особым белком (ферритином).
Микроэлементы. У каждого микроэлемента, присутствующего в организме, своя особая функция, связанная с тем, что он стимулирует действие того или иного фермента или как-либо иначе на него влияет. Цинк необходим для кристаллизации инсулина; кроме того, он является компонентом карбоангидразы (фермента, участвующего в транспорте диоксида углерода) и некоторых других ферментов. Молибден и медь – тоже необходимые компоненты различных ферментов. Иод требуется для синтеза трииодтиронина, гормона щитовидной железы. Фтор (входящий в состав зубной эмали) способствует предотвращению кариеса.
Использование метаболитов
Углеводы. Всасывание. Моносахариды, или простые сахара, высвобождающиеся при переваривании углеводов пищи, переходят из кишечника в кровоток в результате процесса, называемого всасыванием. Механизм всасывания представляет собой сочетание простой диффузии и химической реакции (активного всасывания). Одна из гипотез, касающихся природы химической фазы процесса, предполагает, что в этой фазе моносахариды соединяются с фосфорной кислотой в реакции, катализируемой ферментом из группы киназ, после чего проникают в кровеносные сосуды и здесь высвобождаются в результате ферментативного дефосфорилирования (разрыва фосфатной связи), катализируемого одной из фосфатаз. Именно активным всасыванием объясняется то, что разные моносахариды всасываются с разной скоростью и что углеводы всасываются даже тогда, когда уровень сахара в крови выше, чем в кишечнике, т.е. в условиях, когда естественно было бы ожидать их перемещения в обратном направлении – из крови в кишечник.
Механизмы гомеостаза. Поступающие в кровоток моносахариды повышают уровень сахара в крови. При голодании концентрация глюкозы в крови колеблется обычно от 70 до 100 мг на 100 мл крови. Этот уровень поддерживается с помощью механизмов, называемых механизмами гомеостаза (самостабилизации). Как только уровень сахара в крови в результате всасывания из кишечника повышается, в действие вступают процессы, выводящие сахар из крови, так что уровень его колеблется не слишком сильно.
Подобно глюкозе, все прочие моносахариды поступают из кровотока в печень, где превращаются в глюкозу. Теперь они неотличимы как от глюкозы, которая всосалась, так и от той, что уже была в организме, и подвергаются тем же метаболическим превращениям. Один из механизмов гомеостаза углеводов, функционирующий в печени, – это гликогенез, посредством которого глюкоза переходит из крови в клетки, где превращается в гликоген. Гликоген хранится в печени до тех пор, пока не произойдет снижение уровня сахара в крови: в этой ситуации гомеостатический механизм вызовет распад накопленного гликогена до глюкозы, которая вновь поступит в кровь.
Превращения и использование. Поскольку кровь поставляет глюкозу во все ткани тела и все ткани используют ее для получения энергии, уровень глюкозы в крови снижается главным образом за счет ее использования.
В мышцах глюкоза крови превращается в гликоген. Однако мышечный гликоген не может быть использован для получения глюкозы, которая перешла бы в кровь. В нем заключен запас энергии, и скорость его использования зависит от мышечной активности. В мышечной ткани содержатся два соединения с большим запасом легко доступной энергии в форме богатых энергией фосфатных связей – креатинфосфат и аденозинтрифосфат (АТФ). При отщеплении от этих соединений их фосфатных групп высвобождается энергия для мышечного сокращения. Чтобы мышца вновь могла сокращаться, эти соединения должны быть восстановлены в своей исходной форме. Для этого требуется энергия, которую поставляет окисление продуктов распада гликогена. При мышечном сокращении гликоген превращается в глюкозофосфат, а затем – через ряд реакций – во фруктозодифосфат. Фруктозодифосфат распадается на два трехуглеродных соединения, из которых после ряда этапов образуется сначала пировиноградная кислота, а в конечном итоге – молочная кислота, как об этом уже говорилось при описании метаболизма углеводов. Это превращение гликогена в молочную кислоту, сопровождающееся высвобождением энергии, может происходить в отсутствие кислорода.
При недостатке кислорода молочная кислота накапливается в мышцах, диффундирует в кровоток и поступает в печень, где из нее вновь образуется гликоген. Если кислорода достаточно, то молочная кислота в мышцах не накапливается. Вместо этого она, как это описано выше, полностью окисляется через цикл трикарбоновых кислот до диоксида углерода и воды с образованием АТФ, который может быть использован для сокращения.
Метаболизм углеводов в нервной ткани и эритроцитах отличается от метаболизма в мышцах тем, что гликоген здесь не участвует. Однако и здесь промежуточными продуктами являются пировиноградная и молочная кислоты, образующиеся при расщеплении глюкозофосфата.
Глюкоза используется не только в клеточном дыхании, но и во многих других процессах: синтезе лактозы (молочного сахара), образовании жиров, а также особых сахаров, входящих в состав полисахаридов соединительной ткани и ряда других тканей.
Гликоген печени, синтезируемый при всасывании углеводов в кишечнике, служит самым доступным источником глюкозы, когда всасывание отсутствует. Если этот источник оказывается исчерпанным, в печени начинается процесс глюконеогенеза. Глюкоза образуется при этом из некоторых аминокислот (из 100 г белка образуется 58 г глюкозы) и нескольких других неуглеводных соединений, в том числе из глицериновых остатков нейтральных жиров.
Некоторую, хотя и не столь важную, роль в метаболизме углеводов играют почки. Они выводят из организма избыток глюкозы, когда ее концентрация в крови слишком высока; при меньших концентрациях глюкоза практически не выводится.
В регулировании метаболизма углеводов участвует несколько гормонов, в том числе гормоны поджелудочной железы, передней доли гипофиза и коры надпочечников.
Гормон поджелудочной железы инсулин снижает концентрацию глюкозы в крови и повышает ее концентрацию в клетках. По-видимому, он стимулирует также и запасание гликогена в печени. Кортикостерон, гормон коры надпочечников, и адреналин, вырабатываемый мозговым веществом надпочечников, воздействуют на метаболизм углеводов, стимулируя распад гликогена (главным образом в мышцах и печени) и синтез глюкозы (в печени).
Липиды. Всасывание. В кишечнике после переваривания жиров остаются главным образом свободные жирные кислоты с небольшой примесью холестерина и лецитина и следами жирорастворимых витаминов. Все эти вещества очень тонко диспергированы благодаря эмульгирующему и солюбилизирующему действию солей желчных кислот. Солюбилизирующее действие обычно связывают с образованием нестойких химических соединений между жирными кислотами и солями желчных кислот. Эти комплексы проникают в клетки эпителия тонкого кишечника и здесь распадаются на жирные кислоты и соли желчных кислот. Последние переносятся в печень и вновь секретируются с желчью, а жирные кислоты вступают в соединение с глицерином или холестерином. Образовавшиеся реконструированные жиры поступают в лимфатические сосуды брыжейки в форме млечного сока, т.н. «хилуса». Из сосудов брыжейки хилус по лимфатической системе через грудной проток поступает в кровеносную систему.
После переваривания пищи содержание липидов в крови возрастает приблизительно от 500 мг (уровень при голодании) до 1000 мг на 100 мл плазмы. Присутствующие в крови липиды представляют собой смесь жирных кислот, нейтральных жиров, фосфолипидов (лецитина и кефалина), холестерина и эфиров холестерина.
Распределение. Кровь доставляет липиды в разные ткани тела и прежде всего в печень. Печень обладает способностью модифицировать поступающие в нее жирные кислоты. Это особенно выражено у видов, запасающих жиры с высоким содержанием насыщенных или, наоборот, ненасыщенных жирных кислот: в печени этих животных соотношение насыщенных и ненасыщенных кислот изменяется таким образом, что отлагающийся жир по своему составу соответствует жиру, свойственному данному организму.
Жиры в печени либо используются для получения энергии, либо переходят в кровь и доставляются ею в разные ткани. Здесь они могут включаться в структурные элементы тканей, но большая их часть отлагается в жировых депо, где они хранятся до тех пор, пока не возникнет потребность в энергии; тогда они снова переносятся в печень и подвергаются здесь окислению.
Метаболизм липидов, как и углеводов, регулируется гомеостатически. Механизмы гомеостаза, воздействующие на липидный и углеводный обмен, видимо, тесно связаны, поскольку при замедлении метаболизма углеводов усиливается метаболизм липидов, и наоборот.
Превращения и использование. Четырехуглеродные кислоты – ацетоуксусная (продукт конденсации двух ацетатных единиц) и -гидроксимасляная – и трехуглеродное соединение ацетон, образующийся при отщеплении одного атома углерода от ацетоуксусной кислоты, известны под общим названием кетоновых (ацетоновых) тел. В норме кетоновые тела присутствуют в крови в небольших количествах. Избыточное их образование при тяжелом диабете ведет к повышению их содержания в крови (кетонемия) и в моче (кетонурия) – это состояние обозначают термином «кетоз».
Белки. Всасывание. При переваривании белков пищеварительными ферментами образуется смесь из аминокислот и небольших пептидов, содержащих от двух до десяти остатков аминокислот. Эти продукты всасываются слизистой кишечника, и здесь гидролиз завершается – пептиды также распадаются до аминокислот. Поступившие в кровь аминокислоты смешиваются с находящимися здесь такими же аминокислотами. В крови содержится смесь из аминокислот, поступивших из кишечника, образовавшихся при распаде тканевых белков и синтезированных организмом заново.
Синтез. В тканях непрерывно идет распад белков и их новообразование. Содержащиеся в крови аминокислоты избирательно поглощаются тканями как исходный материал для построения белков, а из тканей в кровь поступают другие аминокислоты. Синтезу и распаду подвергаются не только структурные белки, но и белки плазмы крови, а также белковые гормоны и ферменты.
Во взрослом организме аминокислоты или белки практически не запасаются, поэтому удаление аминокислот из крови происходит с такой же скоростью, как и их поступление из тканей в кровь. В растущем организме формируются новые ткани, и на этот процесс расходуется больше аминокислот, чем поступает в кровь за счет распада тканевых белков.
Печень участвует в метаболизме белков самым активным образом. Здесь синтезируются белки плазмы крови – альбумины и глобулины – а также собственные ферменты печени. Так, при потере плазменных белков содержание альбумина в плазме восстанавливается – за счет интенсивного синтеза – довольно быстро. Аминокислоты в печени используются не только для образования белков, но подвергаются также расщеплению, в ходе которого извлекается заключенная в них энергия.
Превращения и использование. Если аминокислоты используются в качестве источника энергии, то отщепляемая от них аминогруппа (–NH2) направляется на образование мочевины, а не содержащий азота остаток молекулы окисляется приблизительно так же, как глюкоза или жирные кислоты.
Так называемый «орнитиновый цикл» описывает, как происходит превращение аммиака в мочевину. В этом цикле аминогруппа, отщепившаяся от аминокислоты в форме аммиака, присоединяется вместе с диоксидом углерода к молекуле орнитина с образованием цитруллина. Цитруллин присоединяет второй атом азота, на этот раз от аспарагиновой кислоты, и превращается в аргинин. Далее аргинин подвергается гидролизу с образованием мочевины и орнитина. Орнитин может теперь вновь вступить в цикл, а мочевина выводится из организма через почки как один из конечных продуктов метаболизма.
Список литературы
Ленинджер А. Основы биохимии, тт. 1–3. М., 1985
Страйер Л. Биохимия, тт. 1–3. М., 1985
Марри Р., Греннер Д., Мейес П., Родуэлл В. Биохимия человека, тт. 1–2. М., 1993
Албертс Б., Брей Д., Льюс Д. и др. Молекулярная биология клетки, тт. 1–3. М., 1994